
����Ŀ����ijһ�¶��£�ijһ�ܱ������У�M��N��R��������Ũ�ȵı仯��ͼa��ʾ���������������䣬���¶ȷֱ�ΪT1��T2ʱ��N�����������ʱ���ϵ��ͼb��ʾ�������н�����ȷ���ǣ� �� 
A.�÷�Ӧ���Ȼ�ѧ����ʽM��g��+3N��g��2R��g����H��0
B.�ﵽƽ����������������䣬��С���������ƽ�����淴Ӧ�����ƶ�
C.�ﵽƽ����������������䣬�����¶ȣ������淴Ӧ�ٶȾ�����M��ת���ʼ�С
D.�ﵽƽ����������������䣬ͨ��ϡ�����壬ƽ��һ��������Ӧ�����ƶ�
���𰸡�C
���������⣺A����ͼa�ɵó�M��NΪ��Ӧ�RΪ������ɡ�c֮�ȿ�֪��ѧ������֮�ȣ��÷�ӦΪM��g��+3N��g��2R��g������ͼb��Ҳ����T1��T2 �� �����¶ȣ�N������������ƽ�������ƶ����ʸ÷�ӦΪ���ȷ�Ӧ����H��0����A���� B����С�����������������ѹǿ��ƽ�������ƶ�����B����
C�������¶ȣ�v����v��������ƽ�������ƶ���M��ת���ʼ�С����C��ȷ��
D�������ں��º��ݵ�������ͨ��ϡ�����壬��ƽ�ⲻ�ƶ�����D����
��ѡC��
A����ͼb��Ҳ����T1��T2 �� �����¶ȣ�N������������
B����С�����������������ѹǿ��
C�������¶ȣ�v����v��������ƽ�������ƶ���
D������ʱ��ͨ��ϡ�����壬M��N��R��Ũ�Ȳ��䣮


 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д� �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ����Ũ��Ϊ0.1000 mol��L��1 NaOH��Һ�ֱ�ζ�20.00 mLŨ�Ⱦ�Ϊ0.100 0 mol��L��1��������HX��HY��HZ���ζ�������ͼ��ʾ������˵����ȷ����( )

A����ͬŨ��ʱ�������������ǿ��˳���ǣ�HX>HY>HZ
B�����ݵζ����߿ɵã�Ka(HX)��10��3 mol��L��1
C���ζ�HY��V(NaOH)��20 mLʱ��c(Na��)��c(Y��)>c(OH��)��c(H��)
D���ζ�HZ��V(NaOH)��15 mLʱ��c(Z��)>c(Na��)>c(H��)>c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����Ag2S(s)![]() 2Ag��(aq)��S2��(aq)����Ksp�ı���ʽΪ________��
2Ag��(aq)��S2��(aq)����Ksp�ı���ʽΪ________��
(2)����˵������ȷ����______________(�����)��
����ϡ����ϴ��AgCl��������ˮϴ�����AgCl��
��һ��أ����ʵ��ܽ�����¶ȵ����߶����ӣ������ʵ��ܽ��������ȵ�
�۶���Al(OH)3(s) ![]() Al(OH)3(aq)
Al(OH)3(aq) ![]() Al3����3OH����ǰ��Ϊ�ܽ�ƽ�⣬����Ϊ����ƽ��
Al3����3OH����ǰ��Ϊ�ܽ�ƽ�⣬����Ϊ����ƽ��
�ܳ�ȥ��Һ�е�Mg2������OH����������CO![]() �ã�˵��Mg(OH)2���ܽ�ȱ�MgCO3�Ĵ�
�ã�˵��Mg(OH)2���ܽ�ȱ�MgCO3�Ĵ�
�ݳ�����Ӧ�г��ӹ����ij���������Ŀ����ʹ��������ȫ
(3)��γ�ȥMg(OH)2�л��е�Ca(OH)2��
___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ܽ�Ȳ�ͬ����˿���������һ���ʣ�������ҺpH���ﵽ����������ӵ�Ŀ�ġ����ܽ��������������ڲ�ͬpH�µ��ܽ��(S/mol��L��1)��ͼ��ʾ��

(1)pH��3ʱ��Һ��ͭԪ�ص���Ҫ������ʽ��________________��
(2)��Ҫ��ȥCuCl2��Һ�е�����Fe3����Ӧ�ÿ�����Һ��Χ��pH ( )
A�� <1 B��4���� C��>6
(3)��Ni(NO3)2��Һ�к���������Co2�����ʣ�________(��ܡ����ܡ�)ͨ��������ҺpH�ķ�������ȥ��������__________________________��
(4)Ҫʹ������ͭ�����ܽ⣬���˼�����֮�⣬�����Լ��백ˮ����[Cu(NH3)4]2����д����Ӧ�����ӷ���ʽ__________________________��
(5)��֪һЩ��������ܶȻ��������±���
���� | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3��10��18 | 2.5��10��13 | 1.3��10��35 | 3.4��10��28 | 6.4��10��33 | 1.6��10��24 |
Ϊ��ȥij��ҵ��ˮ�к��е�Cu2����Pb2����Hg2�����ʣ���������˹�ҵ��ˮ�м��������________(��ѡ��)��
A��NaOH B��FeS C��Na2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̶��ݻ�Ϊ2L���ܱ������з�����ӦxA��g��+yB��g��zC��g����ͼI��ʾt��ʱ�����и����ʵ�����ʱ��ı仯��ϵ��ͼII��ʾƽ�ⳣ��K���¶ȱ仯�Ĺ�ϵ�����ͼ���жϣ����н�����ȷ���ǣ� �� 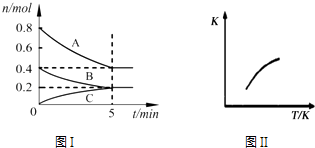
A.�÷�Ӧ�ɱ�ʾΪ��2A��g��+B��g��C��g����H��0
B.t��ʱ�÷�Ӧ��ƽ�ⳣ��K=6.25
C.�������������ܶȲ��ٱ仯ʱ���÷�Ӧ�ﵽƽ��״̬
D.t�棬�ڵ�6 minʱ������ϵ�г���0.4 mol C���ٴδﵽƽ��ʱC�������������0.25
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ��������ǿ���ǣ� ��
A.PH=4
B.C��H+��=1��10��3 molL��1
C.C��OH����=1��10��12
D.C��H+��/C��OH����=1012
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�绯ѧװ�ã���ͼ��ʾ��E Ϊմ�� Na2SO4��Һ����ֽ�������뼸�η�̪��A��B�ֱ�ΪPtƬ��ѹ����ֽ���ˣ�R��SΪ��Դ�ĵ缫��M��N���ö��� Ni �Ƴɵĵ缫���ϣ����ڼ�����Һ�п�����Ϊ���Ե缫��GΪ�����ƣ�KΪ���أ�C��D�͵����ж�����ŨKOH��Һ��������ֽ�������һ����ɫ�� KMnO4��Һ���Ͽ�K����ͨ���Դһ��ʱ���C��D������������� 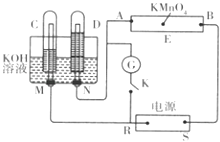
��1��S�����������������
��2��A��������Һ�������� �� B �����������ĵ缫��ӦʽΪ ��
��3����ֽ�ϵ���ɫ�������A����B�������ƶ���
��4���� C��D������������һ����ʱ���ж����Դ����ͨ����K������һ��ʱ�䣬C��D���������٣�D�еĵ缫Ϊ������������������缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ���ͨ�����Ϸ�Ӧ�Ƶõ���
A.Na2CO3B.NaHCO3C.Al(OH)3D.Fe(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��Ӧʱ�������������Ƶ������ص���( )
A. �۵�� B. Ӳ��С C. �ܶ�С D. �ܻ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com