
 已知某种燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
已知某种燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
| 2.2g |
| 44g/mol |
| 2 |
| 18 |


科目:高中化学 来源: 题型:
| A、向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量却并非是最大值 |
| B、将0.12mol Cl2通入到100mL 1mol/L的FeI2溶液中,离子方程式是:12Cl2+10Fe2++14I-→10Fe3++7I2+24Cl- |
| C、较高的温度下,可以测得0.1mol/L氨水的电离度为55%左右 |
| D、十六烷的裂化产物中不饱和烃的分子数可能会超过50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫在氧气中剧烈燃烧,发出蓝紫色火焰 |
| B、红热的铁丝在氧气中燃烧,火星四射,生成黑色颗粒 |
| C、SO2通入石蕊试剂中,溶液先变红后褪色 |
| D、钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.(相对原子质量 C-12 H-1 O-16)
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.(相对原子质量 C-12 H-1 O-16)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
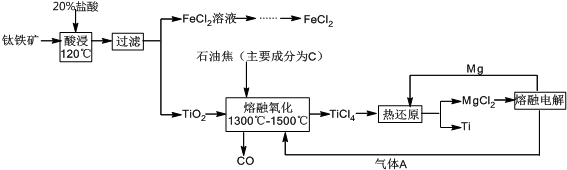
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com