
| A. | NO2 | B. | NO | C. | N2O | D. | NH4NO3 |
分析 锌和稀硝酸发生氧化还原反应,起反应的锌和硝酸的物质的量之比为4:10,假设锌为4mol,生成硝酸锌为4mol,作酸性的硝酸为8mol,则锌与被还原的硝酸的物质的量之比为4:2,则被还原的硝酸为2mol,结合电子的转移数目相等计算.
解答 解:锌和稀硝酸发生氧化还原反应,起反应的锌和硝酸的物质的量之比为4:10,假设锌为4mol,生成硝酸锌为4mol,作酸性的硝酸为8mol,则锌与被还原的硝酸的物质的量之比为4:2,则被还原的硝酸为2mol,
反应后Zn被氧化为+2价,设硝酸还原产物为x价,
则4mol×(2-0)=2mol×(5-x),
x=+1,则还原产物N2O,或NH4NO3,
故选CD.
点评 本题考查氧化还原反应的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电子守恒计算该题,题目难度中等.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
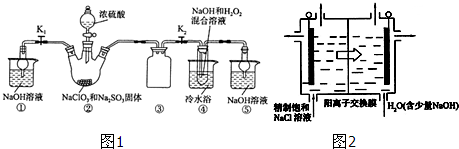
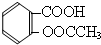 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2: .
. +3NaOH
+3NaOH CH3COONa+2H2O+
CH3COONa+2H2O+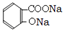 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1 mol该原子质量为aNAg | ||
| C. | x g该氧原子所含的电子数为$\frac{8x}{a}$ | D. | y g该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CO32-+7H2O.
CO32-+7H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,C元素在周期表中的位置第三周期ⅥA族.
,C元素在周期表中的位置第三周期ⅥA族. 或
或


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com