
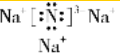 ,该化合物是离子化合物(选填“离子”、“共价”).
,该化合物是离子化合物(选填“离子”、“共价”).分析 (1)氮化钠是离子化合物,三个钠原子失去三个电子,给N原子,使N原子最外层达到稳定结构,电子式需要标注离子所带电荷数;
(2)氮化钠与水反应生成NH3和一种强碱,根据反应方程式的特点,强碱只能是NaOH,实质是Na+结合水电离出的OH-,N3-结合水电离出的H+,故属于复分解反应;
(3)氮化钠先跟水反应:Na3N+3H2O=NH3↑+3NaOH,NH3与盐酸反应生成NH4Cl,NaOH与盐酸反应生成NaCl,盐有2种,NH4Cl是离子化合物,既含有离子键又有共价键;
(4)这两种离子的核外电子排布相同,核外电子排布相同,离子半径随原子序数的增大而减小;
解答 解:(1)氮化钠是离子化合物,三个钠原子失去三个电子,给N原子,使N原子最外层达到稳定结构,其电子式为: ,
,
故答案为: ;
;
(2)氮化钠与水反应生成NH3和一种强碱,根据反应方程式的特点,强碱只能是NaOH,其反应方程式:Na3N+3H2O=NH3↑+3NaOH,实质是Na+结合水电离出的OH-,N3-结合水电离出的H+,故属于复分解反应,
故答案为:Na3N+3H2O=NH3↑+3NaOH,复分解;
(3)氮化钠先跟水反应:Na3N+3H2O=NH3↑+3NaOH,NH3与盐酸反应生成NH4Cl,NaOH与盐酸反应生成NaCl,盐有2种,NH4Cl是离子化合物,既含有离子键又有共价键,NaCl也是离子化合物,只含有离子键,
故答案为:两种,NH4Cl;
(4)这两种离子的核外电子排布相同,核外电子排布相同,离子半径随原子序数的增大而减小,故r(Na+)<r(N3-),填“小于”.
故答案为:小于;
点评 本题考查电子式、化学反应方程式、化学键、离子半径的大小比较等知识,主要是物质性质的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.1 g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1 mol丙烯醛中含有双键的数目为0.1 NA | |
| C. | 标准状况下,2.24 L乙醇中含有分子的数目为0.1NA | |
| D. | 0.1 mol的氯气全部溶于水后转移电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
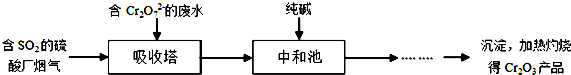
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
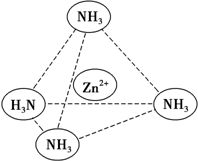 锌是一种重要的金属,锌及其化合物有着广泛的应用.
锌是一种重要的金属,锌及其化合物有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | C. | $\frac{W}{161(W+18a)}$×100% | D. | $\frac{W}{161(W+36a)}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1氨水中c$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,则c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 在0.1 mol•L-1(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)] | |
| D. | 浓度均为0.1 mol•L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合:c(SO42-)=c(Na+)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com