
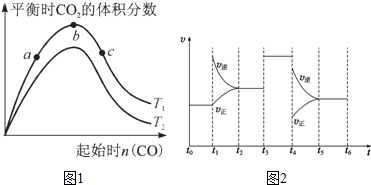
分析 (1)由Ⅰ.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)、
Ⅱ.CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)
可知,(I+Ⅱ)×$\frac{1}{2}$得到$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g);
(2)对反应CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H<0,
①温度相同时,CO越多,SO2的转化率越高;
②相同CO时,升高温度,平衡逆向移动,CO2的体积分数越小;
(3)由t1~t6内反应速率与反应时间图象可知,t1时逆反应速率大于正反应速率,平衡逆向移动;t3时平衡不移动;t4时逆反应速率大于正反应速率,平衡逆向移动,以此来解答.
解答 解:(1)由Ⅰ.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)、
Ⅱ.CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)
可知,(I+Ⅱ)×$\frac{1}{2}$得到$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g),则反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g)的平衡常数K=$\sqrt{({K}_{1}×{K}_{2})}$,
故答案为:$\sqrt{({K}_{1}×{K}_{2})}$;
(2)对反应CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H<0,
①温度相同时,CO越多,SO2的转化率越高,则a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是c,故答案为:c;
②该反应为放热反应,相同CO时,升高温度,平衡逆向移动,CO2的体积分数减小,则T2高于T1,
故答案为:高于;该反应为放热反应,升高温度平衡向逆反应方向移动,CO2体积分数降低,故T2高于T1;
(3)由t1~t6内反应速率与反应时间图象可知,t1时逆反应速率大于正反应速率,平衡逆向移动;t3时平衡不移动;t4时逆反应速率大于正反应速率,平衡逆向移动,A.在t1时若增大了压强,平衡正向移动,正反应速率大于逆反应速率,故A不选;
B.在t3时加入了催化剂,正逆反应速率均增大,平衡不移动,故B选;
C.反应的焓变未知,在t4时不一定降低了温度,故C不选;
D.由上述分析可知,平衡一直逆向移动,则t0~t1时A的转化率最高,故D不选;
故答案为:B.
点评 本题考查化学平衡的计算,为高频考点,把握K与反应的关系、平衡移动、图象分析等为解答的关键,侧重分析与应用能力的考查,注意图象与平衡移动原理的结合,题目难度不大.


科目:高中化学 来源: 题型:选择题
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
| A. |  如图可表示合成氨过程中的能量变化 | |
| B. | a的数值为391 | |
| C. | Q1的数值为92 | |
| D. | 相同条件下,反应物若为2 mol N2和6 mol H2,放出热量Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 | |
| C. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | 0 | ||||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | |||
| 2 | ① | ② | Ne | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com