
分析 (1)根据电子转移守恒计算Fe的物质的量,进而计算Fe的质量分数;
(2)根据总质量计算FeO的质量,再计算FeO的物质的量,根据Fe原子、硫酸根守恒计算H2SO4的物质的量,进而计算H2SO4的物质的量浓度.
解答 解:(1)生成氢气物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,根据电子转移守恒n(Fe)=$\frac{0.05mol×2}{2}$=0.05mol,故Fe的质量为0.05mol×56g/mol=2.8g,则混合物中铁粉的质量分数为$\frac{2.8g}{10g}$×100%=28%,
答:混合物中铁粉的质量分数为28%.
(2)混合物中FeO的质量为10g-2.8g=7.2g,FeO的物质的量为$\frac{7.2g}{72g/mol}$=0.1mol,根据Fe原子、硫酸根守恒,n(H2SO4)=n(FeSO4)=n(Fe)+n(FeO)=0.05mol+0.1mol=0.15mol,则H2SO4的物质的量浓度为$\frac{0.15mol}{0.15L}$=1mol/L,
答:H2SO4的物质的量浓度为1mol/L.
点评 本题考查混合物计算,难度不大,注意利用守恒法避免方程式的繁琐.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅酸可以通过SiO2和水化合反应直接制得 | |
| B. | 可用反应Na2SiO3+2HCl═2NaCl+H2SiO3↓制取硅酸 | |
| C. | 因为硅酸难溶于水,所以它不能与NaOH溶液反应 | |
| D. | 干燥剂“硅胶”的主要成分是硅酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验一:向饱和AlCl3溶液中滴加氨水以制备Al(OH)3胶体 | |
| B. | 实验二:用饱和NaHCO3溶液除去混在Cl2中的HCl气体 | |
| C. | 实验三:用Na2O2与水反应制氧气 | |
| D. | 实验四:用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
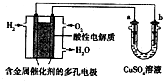
| A. | 燃料电池工作时,正极反应为:O2+4H++4e-═2H2O | |
| B. | a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 | |
| C. | a极是纯铜,b极是粗铜时,可以达到铜的精炼目的 | |
| D. | a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏法是用海水制备淡水的主要方法之一 | |
| B. | 将饱和FeCl3溶液滴入到沸腾的蒸馏水中制备Fe(OH)3胶体 | |
| C. | 将氯气通入到热的氢氧化钠浓溶液中制备漂白液 | |
| D. | 用油脂的碱性水解反应制取肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL 1mol/L NaCl溶液 | B. | 200mL 2mol/L AlCl3溶液 | ||
| C. | 100mL 1mol/L BaCl2溶液 | D. | 100mL 4mol/L KCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com