
1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3) /mol·L-1 | c(H2SO4) /mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时,探究温度对化学反应速率的影响,应选择__________(填实验编号);探究浓度对化学反应速率的影响,应选择__________(填实验编号);若同时选择①②③溶液变浑浊的同时,探究__________对化学反应速率的影响。
(2)已知Na2S2O3溶液与Cl2反应时,1 mol Na2S2O3转移8 mol电子。该反应的离子方程式是____________________________________________________________,
甲同学设计如下实验流程探究Na2S2O 3的化学性质。
3的化学性质。
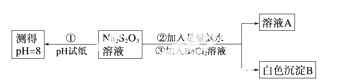
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和________性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是________________________。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是________(填“甲”或“乙”),理由是______________________。
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
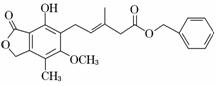
有关下图所示化合物的说法不正确的是 ( )
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1 mol该化合物最多可以与3 mol NaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是( )
A.制取溴苯:将铁屑、溴水、苯混合加热
B.实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
C.鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色
D.通过向溴水中加入乙醇来萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下钛不和非金属、强酸反应。红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是:第一步:金红石、碳粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体,该反应的化学方程式为______________________________,该反应的还原剂是________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)写出此反应的化学方程式:_____________________________________________。
(2)简述从上述所得产物中获取金属钛的步骤___________________________ _______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了 腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了 (“氧化”或“还原”)反应,其电极反应式是 。
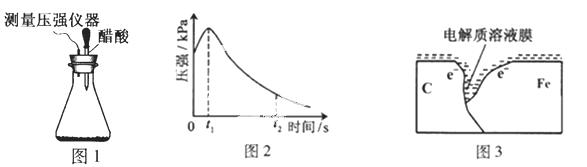
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二: ;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: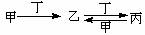 。下列有关物质的推断不正确的是( )
。下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸 D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的值.下列叙述正确的组合是( )
①14g乙烯和丙烯的混合物中氢原子数为2NA个
②0.1mol•L﹣1的FeCl3溶液滴入沸水形成的胶体粒子的数目为0.1NA个
③标准状况下,2.24L Cl2通入足量的NaOH溶液中转移的电子数为0.1NA个
④25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH﹣ 数目为0.2NA个
⑤常温下,100mL 1mol•L﹣1Na2CO3溶液中阴离子总数大于0.1NA个
⑥1mol Na2O2与足量水蒸气反应转移电子数为NA个
⑦常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA个.
A.①④⑤⑦ B. ②⑤⑥⑦ C. ①③⑤⑥ D. ①③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,
反应的化学方程式如下:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用右图装置制取氨气,你所选择的试剂是 。

(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
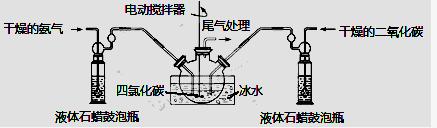
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是_______ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
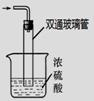
③尾气处理装置如右图所示。双通玻璃管的作用: ;
浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水 充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。则样品中氨基甲酸铵的物质的量分数为 。
[Mr(NH2COONH4)=78g/mol、Mr(NH4HCO3) =79 g/mol、Mr(CaCO3)=100 g/mol]【来.源:全,】
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com