
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.61×10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是__(填化学式)。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为__。
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是_。
A.c(H+) B.c(H+)c(CH3COO-) C.c(H+)c(OH-) D.![]()
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1__V2(填“>”、“<”或“=”)。
(5)下列四种离子结合H+能力最强的是__。
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(6)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是___
A.Va>10Vb B.Va<10Vb C.Vb<10Va D.Vb>10Va
(7)25℃时,0.1mol/L CH3COOH溶液的pH约为3,向其中加入CH3COONa晶体,待晶体溶解后发现溶液的pH增大。可能的原因有:①__;②__;为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L CH3COOH溶液中加入少量下列物质中的__(选填字母编号),然后测定溶液的pH。
a.CH3COOK固体 b.CH3COONH4固体 c.NH3 d.NaHCO3固体
(8)已知100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈__性;
(9)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3H2O溶液中,NH4+浓度由大到小的顺序是:___。
【答案】H3PO4 CO2+H2O+ClO-=HClO+HCO3- D < B D CH3COONa水解呈碱性,增大了c(OH-),使pH增大 CH3COONa溶于水电离出大量的CH3COO,抑制了醋酸的电离,使c(H+)减小,因而pH增大 B 酸 ①②④③⑤
【解析】
(1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数可确定酸性最强的是H3PO4;
(2)由电离常数可知,酸性:H2CO3>HClO>HCO3-,根据“以强制弱”规则可知其反应离子方程式为:CO2+H2O+ClO-=HClO+HCO3-;
(3)加水稀释的过程中,醋酸的电离程度增大,溶液中醋酸浓度、醋酸根、氢离子浓度均减小,稀释过程中,水的电离程度增大,溶液中氢氧根浓度增大,由此可得:c(H+)、c(H+)c(CH3COO﹣)均减小, c(H+)c(OH﹣)为常数,大小不变,![]() 增大,故答案为D;
增大,故答案为D;
(4)由电离常数可知,醋酸的酸性较次氯酸强,相同pH的两种酸,醋酸的浓度较次氯酸小,故中和相同体积和相同pH的两种酸溶液,所用到的NaOH的量关系为:次氯酸大于醋酸,故V2>V1;
(5)根据离子对应酸的酸性越弱,离子结合质子的能力越强,由电离常数可知,这四种酸的酸性关系为:CH3COOH>H2CO3>HClO>HCO3﹣,故结合质子能力最强的离子为CO32-,答案为B;
(6)含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,则有二者物质的量相等,因为所中和的氢氧化钠的物质的量是一定的,而醋酸是弱酸,其醋酸浓度越大,其电离程度越小,pH为2和3的CH3COOH溶液,后者电离程度大,pH为2的CH3COOH的浓度大于pH为3的CH3COOH溶液浓度的10倍,设pH为2的醋酸浓度为x,pH为3的醋酸浓度为y,则有Va×x=Vb×y,则![]() ,即Vb>10Va,答案为D;
,即Vb>10Va,答案为D;
(7)醋酸为弱电解质,醋酸在水溶液中存在电离平衡,加入醋酸钠固体,溶液pH增大,可能的原因有:①CH3COONa水解呈碱性,增大了c(OH-),使pH增大,② CH3COONa溶于水电离出大量的CH3COO,抑制了醋酸的电离,使c(H+)减小,因而pH增大;CH3COONH4溶液中,CH3COO和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1molL1醋酸中使pH增大,说明CH3COO抑制了醋酸的电离,其它物质的水溶液都呈碱性,不能用于证明,故答案为:B;
(8)pH=3的醋酸溶液中醋酸浓度大于0.001mol/L,pH=9的NaOH溶液中氢氧化钠的浓度为0.001mol/L,等体积混合后,酸过量,混合溶液呈酸性,pH<7,溶液呈酸性;
(9)设下列溶液浓度均为1mol/L,
①(NH4)2SO4溶液中NH4+水解不受影响,1mol/L<c(NH4+)<2mol/L,
②NH4HSO4溶液中NH4+水解受到抑制,c(NH4+)<1mol/L,
③NH4HCO3溶液中NH4+水解受到促进,c(NH4+)<1mol/L,
④NH4Cl溶液中NH4+水解不受影响,c(NH4+)<1mol/L,
⑤NH3H2O溶液中NH3H2O电离程度较小,c(NH4+)较低,
最终这五组溶液中,c(NH4+)由大到小的顺序为:①②④③⑤。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的.主要步骤如下:
下列说法不正确的是( )
A. 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳
B. 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤
C. 加入试剂②反应的离子方程式为:OH﹣+H+=H2O
D. 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】425℃时,在两个1L密闭容器中分别发生化学反应,物质的浓度随时间的变化如图所示。下列叙述错误的是( )
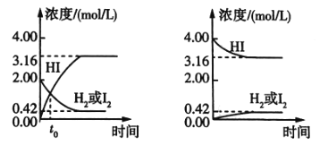
A.图①中t0时,三种物质的物质的量相等
B.图①中![]() 时,反应达到平衡状态
时,反应达到平衡状态
C.图②中的可逆反应为2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
D.图①②中,当c(HI)=3.16mol/L时,两容器中的反应均达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知1g硫完全燃烧释放的热量为akJ,写出硫的燃烧热的热化学方程式__;
(2)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=__kJ·mol-1(用含a、b的代数式表示);
(3)已知 2SO2(g)+O2(g)=2SO3(g) △H反应过程的能量变化如图所示,已知1mol SO2(g)氧化为1mol SO3放出99kJ的热量,请回答下列问题:
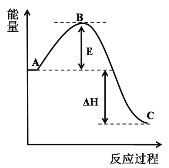
①图中A表示___;
②E的大小对该反应的反应热__(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点__(填“升高”“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,![]() 分子中含有
分子中含有![]()
![]() 个碳氧双键
个碳氧双键
B.一定温度下,![]() 完全反应转移的电子数一定为
完全反应转移的电子数一定为![]()
![]()
C.常温常压下,![]() 固体中离子总数为
固体中离子总数为![]()
![]()
D.常温常压下,![]() 溶液中
溶液中![]() 和
和![]() 数目之和为
数目之和为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,将1L混合烃与9L氧气混合没在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是
A.甲烷与乙烷的体积比是1∶4B.丙炔与乙炔的体积比是1∶4
C.乙烯与丁烷的体积比是1∶4D.乙烯与丁烯的体积比是1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | -2 | -3 | -1 | -3 |
(1)⑧号元素在周期表中的位置是____;上述元素处于同一主族的有____。(用元素符号表示)
(2span>)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式:____。
(3)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
①![]() Li和
Li和![]() Li作核反应堆最佳热载体,
Li作核反应堆最佳热载体,![]() LiH和
LiH和![]() LiD用作高温堆减速剂。下列说法正确的是____。
LiD用作高温堆减速剂。下列说法正确的是____。
A.![]() Li和
Li和![]() Li互为同位素 B.
Li互为同位素 B.![]() Li和
Li和![]() Li属于同种核素
Li属于同种核素
C.![]() LiH和
LiH和![]() LiD的化学性质不同 D.
LiD的化学性质不同 D.![]() LiH和
LiH和![]() LiD是同种物质
LiD是同种物质
②下列说法不正确的是____。
A.碱性:Be(OH)2<LiOH<NaOH<KOH
B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+
D.金属性:Cs>Rb>K>Na>Li>Be
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
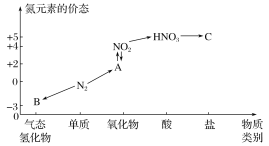
(1)写出N2的两种用途:_________、____。常用作制冷剂的化合物是________(名称)。该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是_________。
(2)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为_______。
(3)NO2与水反应生成物质A的离子方程式为______________。
(4)浓硝酸与木炭在加热条件下反应的化学方程式为___________________。
(5)氨水显碱性,写出氨水的电离方程式______________________________;
(6)氨催化氧化生成NO是工业制硝酸的反应之一,写出该反应的化学方程式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com