
| A. | 葡萄糖、氨基酸在一定条件下都能发生酯化反应 | |
| B. |  的分子式为C17H26O3 的分子式为C17H26O3 | |
| C. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧时消耗氧气的量相等 | |
| D. | 结构片段为 的高聚物,是其单体通过缩聚反应生成的 的高聚物,是其单体通过缩聚反应生成的 |
分析 A.葡萄糖、氨基酸分别含有羟基和羧基;
B.拐点为碳原子,每个碳接四个键,不足的接氢原子;
C.醛和乳酸的最简式相同,等质量的二者完全燃烧时消耗的氧气的量相同;
D.根据该高聚物的主链全部为C可知,该高聚物是通过加聚反应生成的高分子化合物.
解答 解:A.葡萄糖、氨基酸分别含有羟基和羧基,都可发生酯化反应,故A正确;
B.拐点为碳原子,每个碳接四个键,不足的接氢原子, 的分子式为C17H26O3,故B正确;
的分子式为C17H26O3,故B正确;
C.甲醛分子式CH2O,乳酸的最简式为CH2O,所以等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量相等,故C正确;
D.根据该高分子化合物的结构片段可知,主链只含有碳原子,该高分子化合物是通过加聚反应生成的,故D错误.
故选D.
点评 本题考查较为综合,涉及有机物的结构、性质以等,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
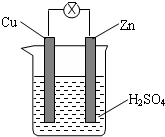
| A. | 烧杯中溶液逐渐呈蓝色 | B. | 锌片逐渐溶解 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 该装置能够将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 组成和结构信息 |
| 甲 | 含有非极性共价键的常见二元离子化合物 |
| 乙 | 含有极性键和非极性键的18e-分子 |
| 丙 | 化学组成为BE,熔点高,可作超硬耐磨涂层材料 |
| 丁 | 化学组成为DBA4的离子化合物 |
 ;
; ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将X、Y分别通入品红溶液中,均使品红溶液褪色 | |
| B. | 将X、Y分别通入氢硫酸中,只有Y能产生沉淀 | |
| C. | 等物质的量的X、Y同时通入品红溶液中,品红溶液不褪色 | |
| D. | 等物质的量的X、Y同时通入BaCl2溶液中,有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
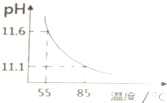
| A. | c(H+)增大,c(OH-)减小 | B. | $\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$比值不断增大 | ||
| C. | c(CO32-)+c(HCO3-)+c(H2CO3)=0.10 | D. | c(OH-)-c(HCO3-)-c(H2CO3)=10-11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com