
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 燃烧一定要有氧气参加 | |
| C. | 吸热反应在常温下也有可能发生 | |
| D. | 氧化还原反应一定是放热反应 |
分析 A.反应速率与反应是吸热还是放热无关;
B.比如金属钠(Na)和氯气(Cl2)反应生成氯化钠(NaCl),该反应没有氧气参加,但是剧烈的发光发热的化学反应;
C.吸热反应与反应条件无关;
D.氧化还原反应不一定是放热反应,如某些分解反应.
解答 解:A.反应速率与反应是吸热还是放热无关,反应速率与反应物本身的性质及外界条件有关,故A错误;
B.燃烧不一定要有氧气参加,比如金属钠(Na)和氯气(Cl2)反应生成氯化钠(NaCl),该反应没有氧气参加,但是剧烈的发光发热的化学反应.同样属于燃烧范畴,故B错误;
C.有的吸热反应在常温下也能发生,如氯化铵和氢氧化钡晶体的反应,故C正确;
D.氧化还原反应不一定是放热反应,可燃物的燃烧、化合反应大都是放热反应,分解反应大都是吸热反应,如高锰酸钾的分解为氧化还原反应,同时也是吸热反应,故D错误.
故选C.
点评 本题考查反应热与能量变化,题目难度不大,注意能量的表现形式以及常见吸热反应、放热反应.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
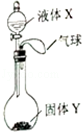 如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( )
如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( )| ① | ② | ③ | ④ | |
| X | 水 | 水 | 稀硫酸 | 双氧水 |
| Y | 硝酸铵 | 氢氧化钠 | 氯化钠 | 二氧化锰 |
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
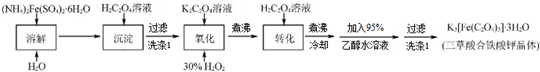
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
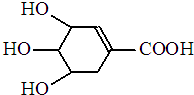 八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )| A. | 能溶于水 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生酯化反应 | D. | 遇FeCl3溶液呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
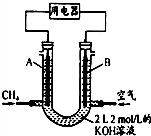
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Cl- | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中①组的反应只可能有一种元素被氧化和一种元素被还原 | |
| B. | 表②中若生成标准状况下6.72LCl2,转移电子数为0.6NA | |
| C. | 由表中①②组反应推测:ClO3-、Br-、H+、Fe2+不能在浓溶液中大量共存 | |
| D. | 表中③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
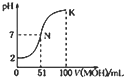 常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )
常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )| A. | HA为一元强酸,NOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | K点所示溶液中c(A-)>c(M+) | |
| D. | K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com