
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型
与氧化还原反应的关系”也可用如图表达。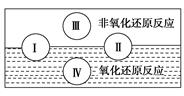
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl Cu+____CuCl2+N2↑+____H2O。
Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)(2011·福建高考卷节选)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+__________。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O +I2===S4O
+I2===S4O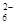 +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示: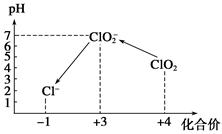
请回答:
①操作Ⅰ中反应的离子方程式是______________________________。
②确定操作Ⅱ完全反应的现象是______________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
(1)氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。PH3分子的空间构型为 ,是 分子。(填极性或非极性)
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)
a.NH3比PH3稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体
亚硝酸盐是食品添加剂中急性毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。
(3)亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色变为绿色,反应如下,补上缺项物质并配平:
Cr2O72-+ NO2-+ → Cr3+ + NO3-+
(4)上题反应中每消耗0.6mol NO2-,转移电子数为 。
(5)氮氧化物(NO和NO2)污染环境。若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1
(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH 2
2CO2(g);ΔH 2
2I2(s)+5O2(g) 2I2O5(s);ΔH 3
2I2O5(s);ΔH 3
则ΔH 1= (用含ΔH 2和ΔH 3的代数式表示)。
(2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答:
①从反应开始至a点时的反应速率为v(CO)= ,b点时化学平衡常数Kb= 。
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线。
③下列说法正确的是 。(填字母序号)
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的平均相对分子质量相等 |
| C.增加I2O5的投料量有利于提高CO的转化率 |
| D.b点和d点的化学平衡常数:Kb<Kd |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3)As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O若生成2 mol H3 AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2和11.2 L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol
c.大于0.5 mol d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有M、R、Q、V、W、X、Y、Z八种物质,它们之间存在如下关系:
①M+Y R ②R+H2O→NaOH+Y ③Q+NaOH→V+W+H2O ④X
R ②R+H2O→NaOH+Y ③Q+NaOH→V+W+H2O ④X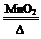 W+Y
W+Y
⑤X+W+H2SO4 Q+Z+H2O。其中M、Q、Y是单质,Q、Y在常温、常压下为气体,Z是硫酸盐,钠、钾化合物性质相似。
Q+Z+H2O。其中M、Q、Y是单质,Q、Y在常温、常压下为气体,Z是硫酸盐,钠、钾化合物性质相似。
回答下列问题:
(1)写出各代号的化学式(或分子式) M , R ,Q ,V ,W ,X ,Y ,Z 。
(2)写出下列有关化学反应的方程式和离子方程式,并标出电子转移方向和总数
反应③ , ;
反应⑤ , 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学实验的微型化可有效减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。[已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O]
(1)e处反应的离子方程式为 ,该反应中发生反应的氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象为 ,d处的实验现象为 。
(3)c处反应的化学方程式为 ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? (填“能”或“不能”),若能,其氧化性由强到弱的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。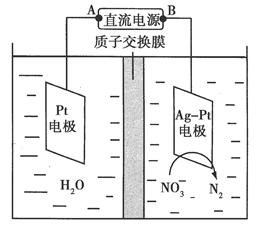
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12。
①N2的结构式为________。
②上述反应离子方程式为____________________,其平均反应速率v(NO3-)为________mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法________。
(2)电化学降解NO3-的原理如图所示。
①电源正极为________(填“A”或“B”),阴极反应式为______________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1。已知2Ag2O(s)=4Ag(s)+O2(g) ΔH=+62.2 kJ·mol-1,则常温下反应2O3(g)=3O2(g)的ΔH=________。
(2)配平下面反应的化学方程式(将各物质的化学计量数填在相应的方框内):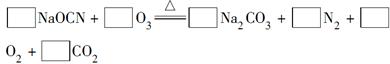
(3)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为_______________________。
(4)空气中臭氧的检测方法是将空气慢慢通过足量KI淀粉溶液,若溶液变蓝色,则说明空气中含有O3。已知O3与KI溶液反应生成两种单质,则该反应的离子方程式为_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com