
 计算SO2的物质的量;
计算SO2的物质的量; 计算各组分的物质的量,根据m=nM计算;
计算各组分的物质的量,根据m=nM计算; 计算SO3的物质的量,进而计算吸收后剩余的三氧化硫的物质的量,根据发烟硫酸中H2SO4和SO3的质量关系列方程计算.
计算SO3的物质的量,进而计算吸收后剩余的三氧化硫的物质的量,根据发烟硫酸中H2SO4和SO3的质量关系列方程计算. =31.25mol,
=31.25mol, =49.11mol,
=49.11mol,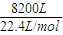 =366.07mol,
=366.07mol, ×100%=7.19%,
×100%=7.19%, =0.01m mol
=0.01m mol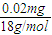 =
= mol,故吸收三氧化硫后生成的硫酸的物质的量为
mol,故吸收三氧化硫后生成的硫酸的物质的量为 mol,发烟硫酸中硫酸的物质的量为0.01m mol+
mol,发烟硫酸中硫酸的物质的量为0.01m mol+ mol=
mol=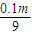 mol,
mol, =3000mol,被水吸收后剩余的三氧化硫的物质的量为3000mol-
=3000mol,被水吸收后剩余的三氧化硫的物质的量为3000mol-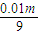 mol,
mol,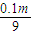 mol×98g/mol:(3000mol-
mol×98g/mol:(3000mol- mol)×80g/mol=(1-20%):20%,解得m=664615g=664.6kg,
mol)×80g/mol=(1-20%):20%,解得m=664615g=664.6kg,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)设上述工厂只生产发烟H2SO4:
①算出1
②算出每1
(2)设上述工厂只生产98%的H2SO4:
①算出每1
②算出同时生产的98% H2SO4的质量。
注:上述气体体积均转化为标准状况下的体积。
(3)若该工厂同时生产发烟硫酸和98%硫酸(两种产物的质量比x=m1/m2,m1和m2分别是发烟硫酸和98%硫酸的质量)。
导出数学表达式,用来描述每1 000 m3出口气体中所消耗水的质量同上述x间的关系。
说明问题(1)和问题(2)中得到的有关数据是否符合你导出的数学表达式。
查看答案和解析>>
科目:高中化学 来源: 题型:
请计算(计算结果保留三位有效数字):
(1)若发烟硫酸用H2SO4·xSO3表示,则x的值是_______;
(2)若只用水吸收SO3(假设吸收完全)生产该发烟硫酸,求出448 m3(已折算成标准状况)“出口气体”所需要用水的质量;
(3)若只用98%的浓H2SO4来完全吸收SO3生产发烟硫酸,计算出448 m3(已折算成标准状况)“出口气体”所需要用98%的浓H2SO4的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com