
 Ǧ���仯������������ء������豸��X���߷������ϵȣ��ش��������⣺
Ǧ���仯������������ء������豸��X���߷������ϵȣ��ش��������⣺���� ��1��C��Pb����ͬһ����Ԫ�أ�Pb��C��4�����Ӳ㣬��Pb����6�����Ӳ㣻Ԫ�طǽ�����Խǿ��������������ˮ��������Խǿ�����������ṩ��Ϣ������Fe3O4����������ʽ��дPb3O4��������������д���ε���ʽʱ��Ҫ�ѻ��ϼ۽ϵ͵�Ԫ����Ϊ�����ӣ��ѻ��ϼ۽ϸߵ�Ԫ�غ���Ԫ����������
��2��������Ǧ��Ũ���ᷴӦ����������ͬʱ�����Ȼ�Ǧ��ˮ��PbO�ʹ������Ʒ�Ӧ���ɶ�����Ǧ���Ȼ��ƣ�
��3����a�������ɱ�ʾΪPbOx������PbO2$\frac{\underline{\;\;��\;\;}}{\;}$PbOx+$\frac{2-x}{2}$O2���з��̼���x��ֵ������ɱ�ʾΪmPbO2•nPbO����Oԭ����Pbԭ�ӵı�ֵΪx���ݴ˼�����
��� �⣺��1��C��Pb����ͬһ����Ԫ�أ�Pb��C��4�����Ӳ㣬��Pb����6�����Ӳ㣬��Pbλ�ڵ������ڵ�IVA�壻Ԫ�طǽ�����Խǿ��������������ˮ��������Խǿ���ǽ�����C��Pb������Ԫ������������ˮ��������Pb�ı�C����������Pb�ڻ���������+2�ۻ�+4�ۣ����ݻ��ϼ۴�����Ϊ���ԭ��д��Pb��������������ʽΪ��PbO��PbO2����ôPb3O4��������ı�ʾ��ʽ����д�� 2PbO•PbO2��
�ʴ�Ϊ���������ڢ�A�壻����2PbO•PbO2��
��2��PbO2��Ũ���Ṳ�����ɻ���ɫ���壬˵�����߷�Ӧ����������ͬʱ�����Ȼ�Ǧ��ˮ����Ӧ����ʽΪPbO2+4HCl��Ũ��=PbCl2+Cl2��+2H2O��PbO�ʹ������Ʒ�Ӧ���ɶ�����Ǧ���Ȼ��ƣ����ӷ���ʽΪPbO+ClO-=PbO2+Cl-���ʴ�Ϊ��PbO2+4HCl��Ũ��=PbCl2+Cl2��+2H2O��PbO+ClO-=PbO2+Cl-��
��3����a�������ɱ�ʾΪPbOx������PbO2$\frac{\underline{\;\;��\;\;}}{\;}$PbOx+$\frac{2-x}{2}$O2����$\frac{2-x}{2}$��32=239��4.0%��x=1.4��
�����ΪmPbO2•nPbO������ԭ���غ�ã�Oԭ�Ӻ�Pbԭ�ӵı�ֵ=x=$\frac{2m+n}{m+n}$=1.4����m��n=2��3��
�ʴ�Ϊ��2��3��
���� ���⿼��̼��Ԫ�����ʣ��漰���ʵ������йؼ��㡢���ӷ�Ӧ��֪ʶ�㣬ע�⣨3���еļ��㣬Ϊ�״��㣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SO4+2NaOH�TNa2SO4+2H2O | B�� | NH3+HCl�TNH4Cl | ||
| C�� | 2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2�� | D�� | CuO+H2$\frac{\underline{\;\;��\;\;}}{\;}$Cu+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| Y | Z | ||
| M | X |
| A�� | ԭ�Ӱ뾶Z��M | |
| B�� | �ǽ����ԣ�X��Z | |
| C�� | MԪ������������Ӧˮ����������� | |
| D�� | Y������������Ӧˮ��������Ա�X���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
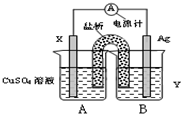 ��ѧ��ѧ����Ҫ����������ʶ��Ȼ������ڵĸ��ָ����ġ�����Ļ�ѧ��Ӧ��̽�����Ļ�ѧ��Ӧ�ı��ʺ��ɣ�ͨ����ѧ��Ӧԭ��ģ���ѧϰ�����ǿ��ԱȽ���̵����⻯ѧ��ѧ�ľ��裬���ѧѧ���������������ѧ��ѧ��Ӧԭ��������������⣮
��ѧ��ѧ����Ҫ����������ʶ��Ȼ������ڵĸ��ָ����ġ�����Ļ�ѧ��Ӧ��̽�����Ļ�ѧ��Ӧ�ı��ʺ��ɣ�ͨ����ѧ��Ӧԭ��ģ���ѧϰ�����ǿ��ԱȽ���̵����⻯ѧ��ѧ�ľ��裬���ѧѧ���������������ѧ��ѧ��Ӧԭ��������������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
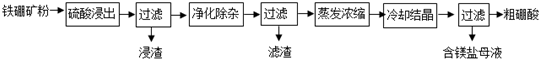
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ | B�� | ��ϩ | C�� | ��ϩ | D�� | �κ�ϩ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com