
(8分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- ,
(2)由第二份进行的实验可知混合物中应含 离子,其物质的量浓度为 。
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量 。
(4)综合上述实验,你认为以下结论正确的是( )
A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol
B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl-
C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl-
D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl-
(1)否 ;(2)NH4+ 0.8 mol/L(3)BaCO3 BaSO4 ; n (CO32-)=0.04mol n(SO42-)=0.02mol (4)A
【解析】
试题分析:(1)第一份:第一份加入AgNO3,溶液有沉淀产生,说明溶液中可能存在:Cl-、CO32-、SO42-;第二份:加足量NaOH溶液加热后生成的0.08mol气体为氨气,则溶液中一定含有NH4+,且物质的量为0.08mol;第三份:根据题中信息可知4.66为硫酸钡,n(BaSO4)=n(SO42-)=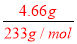 =0.02mol;12.54g为硫酸钡和碳酸钡,所以碳酸钡的物质的量为:
=0.02mol;12.54g为硫酸钡和碳酸钡,所以碳酸钡的物质的量为: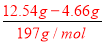 =0.04mol;再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.08mol;n(-)=2n(CO32-)+2n(SO42-)=0.12mol,故一定有K+,至少0.04mol,浓度至少是0.8mol/L;(1)由于碳酸根离子、硫酸根离子都能够与银离子反应生成碳酸银、硫酸银沉淀,所以无法确定原溶液中是否存在氯离子,故答案为:不一定,因为碳酸银、硫酸银都是沉淀;(2)加足量NaOH溶液加热后,收集到0.08mol气体,该气体为氨气,说明溶液中 一定存在铵离子,铵离子的物质的量浓度为:c(NH4+)=
=0.04mol;再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.08mol;n(-)=2n(CO32-)+2n(SO42-)=0.12mol,故一定有K+,至少0.04mol,浓度至少是0.8mol/L;(1)由于碳酸根离子、硫酸根离子都能够与银离子反应生成碳酸银、硫酸银沉淀,所以无法确定原溶液中是否存在氯离子,故答案为:不一定,因为碳酸银、硫酸银都是沉淀;(2)加足量NaOH溶液加热后,收集到0.08mol气体,该气体为氨气,说明溶液中 一定存在铵离子,铵离子的物质的量浓度为:c(NH4+)= =0.8mol/L,故答案为:NH4+;0.8mol/L;(3)加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,说明沉淀为硫酸钡和碳酸钡的混合物,其中4.66g为硫酸钡沉淀,n(BaSO4)=n(SO42-)=
=0.8mol/L,故答案为:NH4+;0.8mol/L;(3)加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,说明沉淀为硫酸钡和碳酸钡的混合物,其中4.66g为硫酸钡沉淀,n(BaSO4)=n(SO42-)=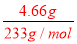 =0.02mol;碳酸钡沉淀的质量为:12.54g-4.66g=7.88g,所以n(BaCO3)=n(CO32- )=
=0.02mol;碳酸钡沉淀的质量为:12.54g-4.66g=7.88g,所以n(BaCO3)=n(CO32- )=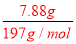 =0.04mol,故答案为:BaCO3、BaSO4;n (CO32-)=0.04mol n(SO42-)=0.02mol(4)根据以上分析可知,溶液中一定存在:K+、NH4+、CO32-、SO42-,可能含有Cl-,若存在氯离子,钾离子的物质的量大于0.04mol;若不存在氯离子,钾离子的物质的量为0.04mol,所以A正确,故选A.
=0.04mol,故答案为:BaCO3、BaSO4;n (CO32-)=0.04mol n(SO42-)=0.02mol(4)根据以上分析可知,溶液中一定存在:K+、NH4+、CO32-、SO42-,可能含有Cl-,若存在氯离子,钾离子的物质的量大于0.04mol;若不存在氯离子,钾离子的物质的量为0.04mol,所以A正确,故选A.
考点:常见离子的检验方法


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015湖南省长沙市望城区高二上学期期末化学文科试卷(解析版) 题型:选择题
化学与生活密切相关,下列说法正确的是
A.塑料老化是由于发生了加成反应
B.煤的气化是物理变化
C.光导纤维是一种合成纤维
D.粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高二上学期期末化学理科试卷(解析版) 题型:选择题
下列物质中只含有离子键的是
A.H2O2 B.NaCl C.HCl D.NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省师大一附高一上学期期中化学试卷(解析版) 题型:选择题
在相同的温度和压强下,4个容器中分别装有4种气体。已知各容器中的气体和容器的容积分别是a.CO2,100 mL;b.O2,200 mL;c.N2,400 mL;d.CH4,600 mL,则4个容器中气体的质量由大到小的顺序是
A.a>b>c>d B.b>a>d>c
C.c>d>b>a D.d>c>a>b
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省师大一附高一上学期期中化学试卷(解析版) 题型:选择题
下列各组离子中,在酸性溶液中能大量共存,且溶液为无色透明的是
A.K+、MnO4-、Cl-、SO42- B.Na+、CO32-、 Cl-、SO42-
C.NO3-、Na+、HCO3-、Ba2+ D.Na+、NO3-、NH4+、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高一上学期期中化学试卷(解析版) 题型:选择题
将12mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为
A. 50mL B. 50.5mL C. 55mL D. 59.5mL
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高一上学期期中化学试卷(解析版) 题型:选择题
某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高一上学期期末考试化学试卷(解析版) 题型:填空题
(12分:除注明分数的小题之外,其余为1分)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是________(用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是______nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是______________(2分),在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)= mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③___________④____________
B请写出通入⑥的化学方程式__________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省岳阳市高三教学质量检测化学试卷(解析版) 题型:选择题
X、Y、Z、W、R属于短周期主族元素。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。下列叙述错误的是
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的氢化物比R的氢化物稳定,熔沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R﹥W﹥Z
D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com