
| m |
| M |
| V |
| Vm |
| m |
| n |
| 3 |
| 2 |
| 0.5mol |
| x |
| 3 |
| 6 |
| 0.5mol |
| y |
| 1 |
| 3 |
| 1 |
| 3 |
| 58.8g-50g |
| 44g/mol |
| 2.24L |
| 22.4l/mol |
| 7.6g |
| 0.1mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、2mol | B、3mol |
| C、64g | D、32g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在2L水中溶有80g的NaOH |
| B、80gNaOH溶于水配成的溶液 |
| C、每升溶液中含有80gNaOH |
| D、每2L溶液中含有80gNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能全部透过半透膜 |
| B、用激光笔照射有光亮的“通路” |
| C、所得溶液一定能导电 |
| D、所得物质一定为悬浊液或乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于1nm |
| B、1-100nm |
| C、大于100nm |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4、C2H4O2 |
| B、C2H2、C6H6 |
| C、CH2O、C3H6O2 |
| D、C2H4、C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
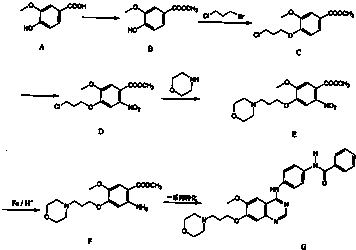
1 |
 )为原料合成对氨基苯甲酸乙酯(
)为原料合成对氨基苯甲酸乙酯(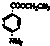 )的合成路线(试剂任选,用合成路线流程图表示)
)的合成路线(试剂任选,用合成路线流程图表示)| HBr |
| NaOH |
| 水/△ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com