
【题目】在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:2CO2(g)+6H2(g)![]() CH3OCH3(g+3H2(g) △H
CH3OCH3(g+3H2(g) △H
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.7kJ.mol-l
CH3OH(g) △H1=-90.7kJ.mol-l
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5kJ.mol-l
CH3OCH3(g)+H2O(g) △H2=-23.5kJ.mol-l
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2kJ.mol-l
CO2(g)+H2(g) △H2=-41.2kJ.mol-l
(1)△H_____ kJ.mol-l
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P前/P后) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则达到平衡时CO的转化率为_________。
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示。从图中可得出三条主要规律:

①增大投料比,CO2的转化率增大;②_____________;③_______________。
(4)反应③的v-t图像如图1所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图像如图2所示。

下列说法正确的是________。
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦ t1<t2 ⑧两图中阴影部分面积相等⑨右图阴影部分面积更大 ⑩左图阴影部分面积更大
A. ①③⑦⑧ B. ①③⑤⑧ C. ②④⑦⑨ D. ①③⑦⑩
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:____________。与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是______________。
【答案】 -122.5 45% 升高温度,CO2的转化率降低 温度越低,增大投料比使CO2的转化率增大的越显著 D CH3OSO3H +CH3OH→CH3OCH3+H2SO4 浓H2SO4腐蚀设备或有硫酸废液产生
【解析】(1)①![]()
![]()
![]()
②![]()
![]()
![]()
③![]()
![]()
![]()
由盖斯定律可以知道,通过①![]() ②
②![]() ③可得所求反应方程式,则
③可得所求反应方程式,则![]()
![]()
![]()
![]()
![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() 。
。
(2)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,![]() ,压强比
,压强比![]() ,则反应后气体的物质的量
,则反应后气体的物质的量![]() ,气体减少的物质的量
,气体减少的物质的量![]() ,根据气体减少的物质的量与CO之间的关系式知参加反应的CO的物质的量
,根据气体减少的物质的量与CO之间的关系式知参加反应的CO的物质的量![]() ,则CO的转化率
,则CO的转化率![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ;
;
(3)根据图象可以知道,![]() 越大,
越大,![]() 的转化率越大,温度越高,
的转化率越大,温度越高,![]() 的转化率小,且图中不同温度线的斜率不同,温度越低,增大投料比使
的转化率小,且图中不同温度线的斜率不同,温度越低,增大投料比使![]() 的转化率增大的越显著,因此,本题正确答案是:升高温度,
的转化率增大的越显著,因此,本题正确答案是:升高温度,![]() 的转化率降低;温度越低,增大投料比使
的转化率降低;温度越低,增大投料比使![]() 的转化率增大的越显著。
的转化率增大的越显著。
反应![]()
![]() 的
的![]() 图象如(4)图1所示,反应前后气体体积不变,若其他条件不变,只是在反应前增大容器体积使压强减小,物质浓度减小,反应速率减小,达到平衡所需时间变长,阴影部分为反应物浓度变化量,图2中浓度变化比图1中浓度变化小,则分析选项得到:
图象如(4)图1所示,反应前后气体体积不变,若其他条件不变,只是在反应前增大容器体积使压强减小,物质浓度减小,反应速率减小,达到平衡所需时间变长,阴影部分为反应物浓度变化量,图2中浓度变化比图1中浓度变化小,则分析选项得到:![]() ,
,![]() ,
,![]() ,两图中阴影部分面积图2阴影部分面积更小,左图阴影部分面积更大,选择①③⑦⑩,所以D选项是正确的,因此,本题正确答案是:D。
,两图中阴影部分面积图2阴影部分面积更小,左图阴影部分面积更大,选择①③⑦⑩,所以D选项是正确的,因此,本题正确答案是:D。
(5)根据元素守恒可以知道硫酸氢甲酯再和甲醇反应生成二甲醚的化学方程式为![]() →
→![]() ,该反应有硫酸参加,因为硫酸是强酸,具有较强的腐蚀性,能腐蚀设备,所以根据硫酸的性质可以知道该工艺的缺点是浓
,该反应有硫酸参加,因为硫酸是强酸,具有较强的腐蚀性,能腐蚀设备,所以根据硫酸的性质可以知道该工艺的缺点是浓![]() 腐蚀设备或有硫酸废液产生,
腐蚀设备或有硫酸废液产生,
因此,本题正确答案是:![]()
![]()
![]() ;浓
;浓![]() 腐蚀设备或有硫酸废液产生
腐蚀设备或有硫酸废液产生


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组查阅资料得知工业上常采用蒽醌法生产 H2O2,其原理与流程如图所示:

下列说法不正确的是
A. 蒽醌法制备 H2O2理论上消耗的原料是H2、O2,乙基蒽醌可循环使用
B. 步骤②为还原反应,步骤③为氧化反应
C. 步骤④中可选用 CCl4作为萃取剂
D. 应除净萃取后工作液残留的H2O2,否则释放的氧气与氢气混合易爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组变化中,化学反应的反应热前者大于后者的一组是( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1; CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2;
②2H2(g)+O2(g)=2H2O(l)△H1; H2(g)+O2(g)=H2O(l)△H2
③t℃时,在一定条件下,将1molSO2和1molO2混合后,分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)=Ca(OH)2(s)△H2
A. ①③④ B. ②③ C. ①④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄曲霉素AFTB1,其结构简式如下图所示,它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性。下列说法正确的是
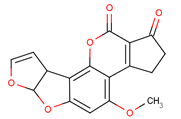
A. 黄曲霉素分子中所有的原子肯定均共面
B. 黄曲霉素分子中含有4个手性碳原子
C. 1mol黄曲霉素最多能与5 mol H2发生加成反应
D. 黄曲霉素可以发生取代、加成、还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾化学式可以用FeSO4xH2O表示,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______、____________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为mg。将样品装入石英玻璃管中,再次将装置A称重,记为ng。按下图连接好装置进行实验。

①将下列实验操作步骤正确排序_______(填标号);重复上述操作步骤,直至A恒重,记为Pg。
a.称量A b.关闭K1和K2 c.点燃酒精灯,加热 d.冷却至室温
e.打开K1和K2,缓缓通入N2 f.熄灭酒精灯
②根据实验记录,计算绿矾化学式中结晶水数目=__________(列式表示)。若实验时按c、e次序操作,则使x_____(填“偏大”“偏小”或“无影响”)。
(3)在蒸馏釜中隔绝空气煅烧绿矾,将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,蒸馏釜中剩余的固体为红棕色。绿矾油中溶质的化学式为______________。
(4)用下图装置模拟(3)中蒸馏釜中反应并检验产物,煅烧绿矾一段时间后,发现D中U型管出现无色粘稠的液体,b中品红溶液褪色。

已知:三氧化硫的熔点为16.8℃,沸点为44.8℃
①A中提供热源的仪器名称:______,上述装置正确的连接顺序A→___________ (用大写字母表示)。
②写出煅烧绿矾的化学方程式_____________。
③实验过程中不宜加入过多绿矾,主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A含碳72.0%、含氢为6.67%,其余为氧用质谱法分析得知A的相对分子质量为150,A在光照条件下生成一溴代物B,B分子的核磁共振氢谱中有4组峰,峰面积比为2:2:2:3,B可发生如下转化关系(无机产物略):

已知:①K与氧化铁溶液发生显色反应,且环上的一元取代物只有两种结构
②当羟基与双键碳原子相连时,会发生如下转化:RCH=CHOH→RCH2CHO
请回答下列问题:
(1)B中官能团的名称是___________,反应④属于______反应类型。
(2)A的结构简式:___________。
(3)F与银氨溶液反应的离子方程式为:__________________。
(4)写出下列反应的化学方程式
反应②:________________。反应④:_______________________。
(5)N是比K多1个碳原子的同系物,同时符合下列要求的N的同分异构体有_____种。
I.苯环上有两个取代基;II.能发生水解反应;III.与氯化铁溶液发生显色反应
其中核磁共振氢谱为5组峰的为_________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为 “零号元素”。下列有关“四中子”粒子的说法不正确的是( )
A.该粒子不显电性B.该粒子质量数为 4
C.在周期表中与氢元素占同一位置D.该粒子质量比氢原子大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置,用环己醇制备环己烯:
已知: 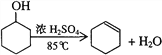
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
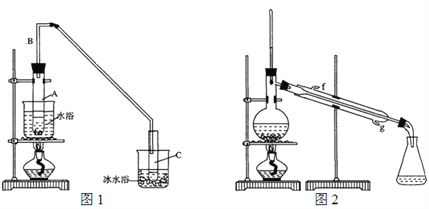
(1)制备粗品:采用如图1所示装置,用环己醇制备环己烯。
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B的作用是_______________。
②试管C置于冰水浴中的目的是________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用________洗涤(填字母)。
A. KMnO4溶液 B. 稀H2SO4 C. Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从____口(填字母)进入。蒸馏时加入生石灰,目的是______________________________________。
③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母)。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________(填字母)。
a. 用酸性高锰酸钾溶液
b. 用金属钠
c. 测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2] 的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是
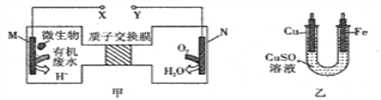
A. 铜电极应与X相连接
B. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
C. 当N电极消耗0.25mol气体时,则铁电极增重16g
D. H+进过质子交换膜由右向左移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com