
| A. | 用乙醚从黄花蒿中提取青蒿素 | B. | 由青蒿素( )合成双氢青蒿素( )合成双氢青蒿素( )的反应 )的反应 | ||
| C. | 空气净化器过滤净化空气 | D. | 消毒柜通电产生臭氧的过程 |
分析 含元素化合价变化的反应为氧化还原反应,有机反应中加O去H为氧化反应,加H去O为还原反应,结合发生的反应及元素的化合价判断.
解答 解:A.用乙醚从黄花蒿中提取青蒿素为萃取原理,为物理变化,故A不选;
B.由青蒿素( )合成双氢青蒿素(
)合成双氢青蒿素( )的反应,C=O转化为-OH,分子中加H,为还原反应,故B选;
)的反应,C=O转化为-OH,分子中加H,为还原反应,故B选;
C.空气净化器过滤净化空气,为过滤原理,为物理变化,故C不选;
D.消毒柜通电产生臭氧的过程,氧气转化为臭氧,没有元素的化合价变化,为非氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意有机物氧化还原反应的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡体系中氮气、氢气、氨的物质的量保持不变 | |
| B. | 平衡体系中氮气、氢气、氨的浓度保持不变 | |
| C. | 单位时间内生成的氨和分解的氨物质的量相同 | |
| D. | 单位时间内消耗的氮气和氢气与生成的氨气物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
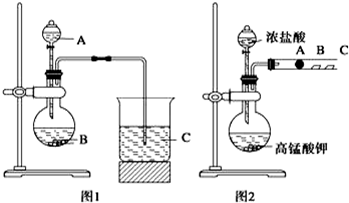
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点由高到低:HF>HCl | B. | 熔点由高到低:K>Li | ||
| C. | 硬度由大到小:金刚石>晶体硅 | D. | 晶格能由大到小:NaF>NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
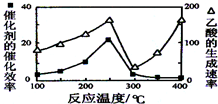 CH4和CO2可以制造价值更高的化学产品.已知:
CH4和CO2可以制造价值更高的化学产品.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
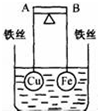 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A 端高B 端低 | |
| B. | 杠杆为导体和绝缘体时,均为A 端低B 端高 | |
| C. | 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 | |
| D. | 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
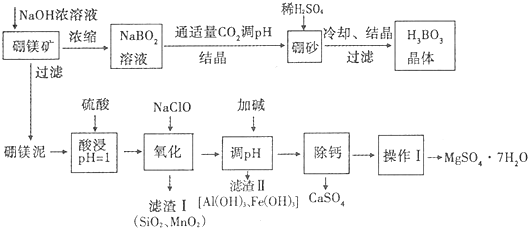
| 化合物 | Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp近似值 | 10-11 | 10-16 | 10-38 | 10-33 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
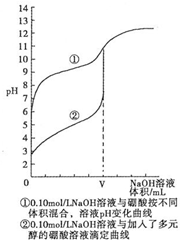
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
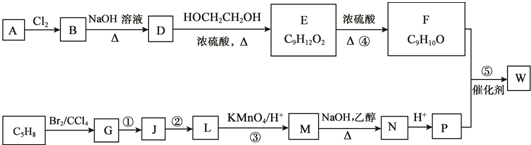
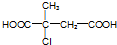 .
. ;D中含氧官能团的名称是羟基;④的反应类型是消去反应.
;D中含氧官能团的名称是羟基;④的反应类型是消去反应.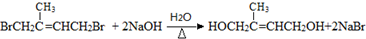 .
. .
.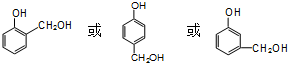 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com