
【题目】从淡化海水中提取溴的流程如下:
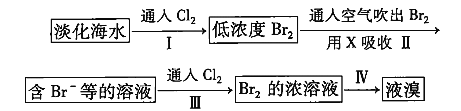
下列有关说法不正确的是( )
A.X可用![]() 饱和溶液
饱和溶液
B.步骤Ⅲ发生的离子反应为![]()
C.工业上每获得1 mol![]() ,至少需要消耗标准状况
,至少需要消耗标准状况![]() 22.4 L
22.4 L
D.步骤Ⅳ涉及的操作有萃取、分液和蒸馏
【答案】C
【解析】
从淡化海水中提取溴,通入氯气后发生置换反应,产生溴单质,通过热空气法移除溴单质后,加入具有还原性的物质与溴单质反应,再次通入氯气置换溴单质,做到浓缩。
A. ![]() 具有还原性,能与溴单质反应生成溴离子,A正确;
具有还原性,能与溴单质反应生成溴离子,A正确;
B. 步骤Ⅲ发生的离子反应为![]() ,B正确;
,B正确;
C. 由流程可知,该工艺先后发生两次反应![]() ,故工业上每获得1 mol
,故工业上每获得1 mol![]() ,至少需要消耗2mol
,至少需要消耗2mol![]() ,其体积在标准状况下的体积为44.8 L,C错误;
,其体积在标准状况下的体积为44.8 L,C错误;
D. 由于液溴易溶于有机溶剂而不易溶于水,故可以用有机溶剂从溴水中提取溴,该方法涉及的操作有萃取、分液后得到溴在有机溶剂中形成的溶液,最后根据溶剂和溴的沸点差别较大,用蒸馏法分离出溴,故步骤Ⅳ涉及的操作有萃取、分液和蒸馏,D正确;
答案为C。


科目:高中化学 来源: 题型:
【题目】某研究小组探究氨基甲酸铵(![]() )分解的化学平衡和水解反应速率。将一定量纯净的氨基甲酸铵置于固定容积为100mL的密闭真空溶液A中,在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
)分解的化学平衡和水解反应速率。将一定量纯净的氨基甲酸铵置于固定容积为100mL的密闭真空溶液A中,在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为![]() ,若25.0℃时达到平衡所用时间为8min,根据数据计算
,若25.0℃时达到平衡所用时间为8min,根据数据计算![]() 的平均生成速率为________________。
的平均生成速率为________________。
②可以判断该分解反应已经达到化学平衡的是_________。
A.2υ(NH3)正=υ(CO2)逆 B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图是1molNO2与1mol CO恰好反应生成CO2和NO过程中的能量变化示意图。
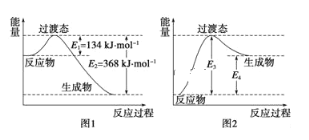
试写出NO2和CO反应的热化学方程式:____,该反应的活化能是____kJmol﹣1。
如图是某学生模仿如图画出的NO(g)+CO2(g)═NO2(g)+CO(g)的能量变化示意图。则图中E3=__kJmol﹣1,E4=__kJmol﹣1。
(2)在密闭容器中充入1mol H2和1mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。保持容器内气体压强不变,向其中加入1molN2,反应速率____(填“变大”、“变小”或“不变”),平衡____移动(填“向正反应方向”、“向逆反应方向”或“不”)。
2HI(g) ΔH<0。保持容器内气体压强不变,向其中加入1molN2,反应速率____(填“变大”、“变小”或“不变”),平衡____移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(3)T℃,向1 L密闭容器中加入1 mol HI(g),发生反应2HI![]() H2+I2,H2物质的量随时间的变化如图所示。
H2+I2,H2物质的量随时间的变化如图所示。
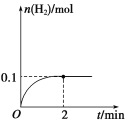
①该温度下,2HI(g) ![]() H2(g)+I2(g)的平衡常数K=____。
H2(g)+I2(g)的平衡常数K=____。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则____是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)![]() SO2Cl2(l)△H=-97.3kJ/mol
SO2Cl2(l)△H=-97.3kJ/mol
(1)若在此条件下,将化学平衡常数K减小,化学反应速率v正增大,可采取的措施是___(选填编号)。
a.升高温度 b.移走SO2Cl2 c.增加反应物浓度 d.无法满足上述条件
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是___(选填编号)。
a.缩小容器体积 b.使用催化剂 c.增加SO2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有___(选填编号)。
a.只有37Cl2 b.只有SO237Cl2 c.37Cl2和SO237Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡状态的是____(选填编号)。
a.υ(Cl2)= υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl2) :c(SO2)=1 :1 d.容器中气体颜色不随时间而变化
(5)300℃时,体积为1L的密闭容器中充入16g SO2Cl2,达到平衡时容器中含SO2 7g。若在上述的平衡体系中,再加入16g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案进行实验探究:
(1)根据方案一装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:
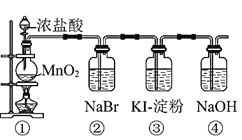
Ⅰ![]() 写出装置①中发生反应的化学方程式:______。
写出装置①中发生反应的化学方程式:______。
Ⅱ![]() 若将反应后②中的溶液倒入
若将反应后②中的溶液倒入![]() 中,出现的现象与图中吻合的是______。
中,出现的现象与图中吻合的是______。![]() 填代号
填代号![]()
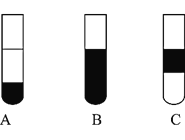
Ⅲ![]() 装置③中的现象是______。
装置③中的现象是______。
(2)根据方案二装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:

Ⅰ![]() 方案二验证元素非金属性递变的理论依据是:______。
方案二验证元素非金属性递变的理论依据是:______。
Ⅱ![]() 装置的作用是______,X是______。
装置的作用是______,X是______。
Ⅲ![]() 能说明碳元素与硅元素非金属性强弱的实验现象是______。
能说明碳元素与硅元素非金属性强弱的实验现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为

A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(气)+3B(气)![]() 2C(气)若达到平衡的标志是
2C(气)若达到平衡的标志是
A. C的生成速率与B的生成速率相等
B. A、B、C的浓度不再发生变化
C. 单位时间内生成nmolA,同时生成3nmolB
D. A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究NOx,SO2等大气污染物的妥善处理具有重要意义。
SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=akJ/mo1;
②NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) △H2=b kJ/mo1;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ/mo1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O △H
(1)△H =______kJ/mo1 (用含a、b、c的代数式表示)。
(2)对于反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △H =-34.0kJ/mol,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
N2(g)+CO2(g) △H =-34.0kJ/mol,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,CO2的平均反应速度v(CO2)=________。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是_______(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(3)用活性炭还原法处理NO,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g) △H =-34.0kJ/mo1。已知在一体积不变的密闭容器中,加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如下图所示:
N2(g)+CO2(g) △H =-34.0kJ/mo1。已知在一体积不变的密闭容器中,加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如下图所示:

①由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;
②在1100K时,CO2的体积分数为________。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H =-746.8 kJ/mo1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H =-746.8 kJ/mo1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”) k逆增大的倍数。
②若在2L的密闭容器中充入2molCO和2molNO,在一定温度下达到平衡时,CO的转化率为50%,则![]() _______。
_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的发明是化学对人类的一项重大贡献。
I:如图所示,烧杯中都盛有稀硫酸。
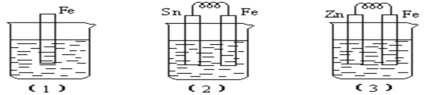
(1)中反应的离子方程式为______________,
(2)中的电极反应:Fe:______________、Sn:______________Sn极附近溶液的pH______________(填增大、减小或不变),
(3)中被腐蚀的金属是______________、比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是______________
II:依据氧化还原反应:Cu+2Fe3+=2Fe2++Cu2+ 设计的原电池如图所示。
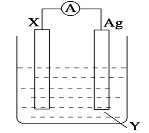
(1)电极 X 的材料是_____;电解质溶液 Y 是_____。
(2)Ag 电极上发生的反应为:_________。
(3)针对上述原电池装置,下列说法中不正确的是_____。(双选)
A.原电池工作时的总反应:Cu+2Fe3+=2Fe2++Cu2+
B.原电池工作时,X 电极流出电子,发生氧化反应
C.原电池工作时,银电极上发生氧化反应
D.原电池工作时,阴离子向 Ag 极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com