
| A. | 若Q1+Q2<Q3,则反应为放热反应 | B. | 若Q1+Q2>Q3,则反应为放热反应 | ||
| C. | 若E1+E2>E3,则反应为吸热反应 | D. | 若E1+E2>E3,则Q1+Q2>Q3 |
科目:高中化学 来源: 题型:解答题

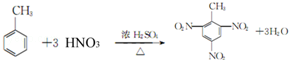
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔 | B. | 丙炔 | C. | 丁炔 | D. | 1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不需要加热就能发生的反应一定是放热反应 | |
| B. | HF、Ca(OH)2、BaSO4都是强电解质 | |
| C. | Na2O2溶于水,生成NaOH,其水溶液能导电,故Na2O2不是电解质 | |
| D. | 升高温度,可同时提高活化分子百分数和活化分子浓度,使化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | 第二次平衡时,Z的浓度为0.2mol•L-1 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 又加入1molZ,平衡没有发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
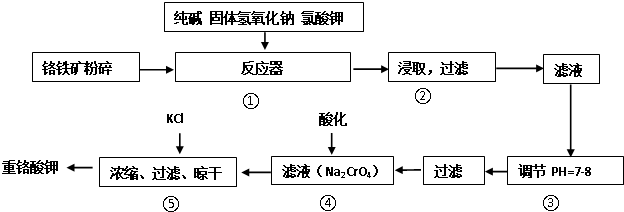
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com