
����Ŀ��ʵ������Ҫ0.1mol/L NaOH��Һ450mL��0.5mol/L������Һ450mL��������������Һ����������ش��������⣺
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����������ţ�������C�������� �� ��ʵ�����貣������E���������� �� 
��2�����в����У�����ƿ�����߱��Ĺ�����������ţ���
A.����һ�����ȷŨ�ȵı���Һ
B.����������Һ
C.���������ܽ��������
D.��ȡһ�������Һ��
��3��������NaOH��Һʵ���У�������������ȷ��������ʱ���ӿ̶��ߣ�����������ҺŨ��0.1mol/L������ڡ������ڡ���С�ڡ�����ͬ������NaOH��Һδ��ȴ��ת��������ƿ���ݣ�����������ҺŨ��0.1mol/L��
��4�����ݼ����֪��������������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ��������ΪmL������������һλС���������ʵ������10mL��25mL��50mL��Ͳ��Ӧѡ��mL������Ͳ��ã�
��5���������ʱ��С�ij����̶��ߣ�Ӧ��β��� ��
���𰸡�
��1��AC����Һ©����500mL����ƿ
��2��BCD
��3��С�ڣ�����
��4��13.6��25.0
��5����������
���������⣺��1������һ�����ʵ���Ũ����Һ��һ�㲽�裺���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȣ��õ���������������ƽ��ҩ�ס��ձ���������������ƿ����ͷ�ιܣ��ò�����������ƽ����ƿ�ͷ�Һ©��������C������Ϊ��Һ©������Ҫ0.1mol/L NaOH��Һ450mL��0.5mol/L������Һ450mL��ʵ����û��450mL����ƿ������Ӧѡ��500mL����ƿ��
���Դ��ǣ�AC����Һ©����500mL����ƿ����2������ƿֻ����������һ�����ȷŨ�ȵ���Һ���������ƻ��������ƿ������µ����������Һ�壬����ϡ�ͻ��ܽ�ҩƷ���������������ܽ�������ʣ�
��ѡ��BCD����3��������ʱ���ӿ̶��ߣ�������Һ���ƫ����ҺŨ��ƫС��
��NaOH��Һδ��ȴ��ת��������ƿ���ݣ���ȴ����Һ���ƫС����ҺŨ��ƫ��
���Դ��ǣ�С�ڣ����ڣ���4����������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ�������ʵ���Ũ��C= ![]() =18.4mol/L����0.5mol/L������Һ500mL��ҪŨ�������ΪV����������Һϡ������Һ�������ʵ����ʵ������ֲ���ã�V��18.4mol/L=0.5mol/L��500mL�����V=13.6mL����ѡ��25mL��Ͳ��
=18.4mol/L����0.5mol/L������Һ500mL��ҪŨ�������ΪV����������Һϡ������Һ�������ʵ����ʵ������ֲ���ã�V��18.4mol/L=0.5mol/L��500mL�����V=13.6mL����ѡ��25mL��Ͳ��
���Դ��ǣ�13.6��25.0����5���������ʱ��С�ij����̶��ߣ�ʵ��ʧ�ܣ��Ҳ��ܲ��ȣ������������ƣ�
���Դ��ǣ��������ƣ�
�����㾫������������һ�����ʵ���Ũ�ȵ���Һ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�������ʵ���Ũ����Һʱ�������ձ�������ˮ������ƿ�̶���1cm��2cm���ٸ��ý�Ͷ�ιܼ�ˮ���̶��ߣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2NO(g)+O2(g)=2NO2(g)�ɢ١���������Ӧ�������䷴Ӧ������������ϵ��ͼ����ʾ����֪��
��NO+O2 =NO3(�췴Ӧ)����NO3+NO=2NO2(����Ӧ)������˵����ȷ����
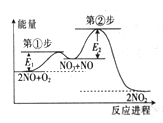
A. NO3��NO�ȶ�
B. �١���������Ӧ��Ϊ���ȷ�Ӧ
C. �ڢڲ����淴Ӧ�Ļ�ܸ������NO2������ת��ΪNO3��NO
D. �����¶ȣ��١���������Ӧ���ʾ��ӿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ0.1mol/L NaOH��Һ450mL��0.5mol/L������Һ450mL��������������Һ����������ش��������⣺
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����������ţ�������C�������� �� ��ʵ�����貣������E���������� �� 
��2�����в����У�����ƿ�����߱��Ĺ�����������ţ���
A.����һ�����ȷŨ�ȵı���Һ
B.����������Һ
C.���������ܽ��������
D.��ȡһ�������Һ��
��3��������NaOH��Һʵ���У�������������ȷ��������ʱ���ӿ̶��ߣ�����������ҺŨ��0.1mol/L������ڡ������ڡ���С�ڡ�����ͬ������NaOH��Һδ��ȴ��ת��������ƿ���ݣ�����������ҺŨ��0.1mol/L��
��4�����ݼ����֪��������������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ��������ΪmL������������һλС���������ʵ������10mL��25mL��50mL��Ͳ��Ӧѡ��mL������Ͳ��ã�
��5���������ʱ��С�ij����̶��ߣ�Ӧ��β��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������ữ�IJ��ᣨH2C2O4����Һ����KMnO4��Һ��Ӧ��ij��ѧС���о����֣�����MnSO4�ɶԸ÷�Ӧ������á�Ϊ��һ���о��й����ضԸ÷�Ӧ���ʵ�Ӱ�죬̽�����£�
��1�������£�̽����ͬ�ij�ʼpH�Ͳ�����ҺŨ�ȶԷ�Ӧ���ʵ�Ӱ�죬�������ʵ�飬��A=_____��C=_____��E=_____��
ʵ���� | �¶� | ��ʼpH | 0.1mol/L������Һ���/mL | 0.01mol/LKMnO4 ��Һ���/mL | ����ˮ���/mL | �������ݣ����Һ��ɫʱ��/s�� |
�� | ���� | 1 | 20 | 50 | 30 | t1 |
�� | ���� | A | B | C | 30 | t2 |
�� | ���� | 2 | 40 | D | E | t3 |
��2���÷�Ӧ�����ӷ���ʽ__________________________________________________��
��3����t1��t2�������ʵ��ٺ͢ڵõ��Ľ�����_____________��
��4��С��ͬѧ����ÿ��ʵ�鷴Ӧ������ʱ��ı仯������ͼ��
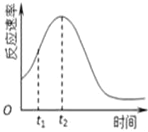
����t1��t2ʱ�������ʱ�����Ҫԭ������ǣ�
��__________________________________________��
��___________________________________________��
��5����ѧС���õζ����ⶨKMnO4��Һ���ʵ���Ũ�ȣ�ȡag���ᾧ�壨H2C2O4��2H2O��Ħ������126g/mol������ˮ���250mL��Һ��ȡ25.00mL��Һ������ƿ�У���������ϡH2SO4�ữ������KMnO4��Һ�ζ����յ㣬�ظ��ζ����Σ�ƽ������KMnO4��ҺVmL����KMnO4��Һ�����ʵ���Ũ��Ϊ_____mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Դ��һ����ȾС�Ŀ�������Դ�������ʵ���Ҫת��;������Ҫ��������ͼ��

��1�������й�˵����ȷ����_____________��
a���������ܣ�������������Դ��̫����
b������ά��ˮ���õ��Ҵ���ȼ������������������
c���������ѽ��õ����͡����͵����ڴ�����
d����ֲ��ո˵��������ͻ�õ���������Ҫ�ɷ��Ǽ���
��2�����������ܻ�õ�CO��H2�����Ժϳɼ״��Ͷ����ѣ�CH3OCH3���������������ʡ�������1��1����Ӧ����ԭ�������ʴ�100%���ϳɵ����ʿ�����____________��
a������ b���״�(CH3OH) c����ȩ(HCHO) d������(CH3COOH)
��3���״���һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ϻϳɼ״��ķ�Ӧ��CO(g)��2H2(g) ![]() CH3OH(g) ��H=��90.8kJ��mol��1�������¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
CH3OH(g) ��H=��90.8kJ��mol��1�������¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | �� | �� | �� |
��Ӧ��Ͷ���� | 1molCO ��2molH2 | 1mol CH3OH | 2molCO��4molH2 |
CH3OH��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
��Ӧ�������仯 | �ų�Q1 kJ | ����Q2 kJ | �ų�Q3 kJ |
ƽ�ⳣ�� | K1 | K2 | K3 |
��Ӧ��ת���� | �� 1 | �� 2 | �� 3 |

����˵����ȷ����________________��
a��c1 = c2 b��2Q1 �� Q3 c��K1 = K3 d����2 + ��3��100%
��4��ijʵ��С�������ͼb��ʾ�ĵ��װ�ã������ĵ缫��ӦʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����( )
A.����ԭ�Ӽ��γɵĹ��ۼ�����Խ��,����Խ��,��Խ�ι�
B.����ԭ�Ӱ뾶֮�;������γɵĹ��ۼ�����
C.����ԭ�Ӽ����Խ��,��Խ�ι�
D.����ǿ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����()
A. �ս�ճ�����մ��漰��ѧ�仯
B. ����ʱ��NH4Cl��Һ����
C. ���������SiO2��Ӧ���ʿ���������ڲ��������Ͽ�ʴ���
D. �ִ�����������Ƕͭ���Ա�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������˵���в���ȷ����(����)
A.���е�����з����Ժͱ������ǵ��±����ܶȱ�ˮС��ԭ��
B.��ˮ������ˮ�ͱ��ж��������
C.���Ӽ����γ�����������ʵ��۵�ͷе�ϸ�
D.HF������������й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��װ�û�������е���Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ���

A. ��ͼ����ʾװ�÷����Ҵ��͵�Ļ��Һ
B. ��ͼ����ʾ��������100 mL 0.1 mol��L-1������Һ
C. ��ͼ����ʾװ���Ʊ�����
D. ��ͼ����ʾװ�ü���Ũ���������Ƿ�Ӧ�����Ķ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com