
【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=__________(用含a的代数式表示)
(2)反应进行到t1时,SO2的体积分数为_______________;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将________(填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量____2.1mol(填“<”、“>”或“=”),简单说明原因:____________。
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆________v正 (填“<”、“>”或“=”)。
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列横线上:
c2______2c1,v1______v2;K1_____K3,p2____2p3;α1(SO2)_____α3(SO2);α2(SO3)+α3(SO2)_______1
【答案】810a 9.52% 增大 > 正反应放热,升温,平衡逆向移动,气体的物质的量增大 < > < > < > <
【解析】
(1)平衡时,体积为aL,

由题可知,(2-2x)+(1-x)+2x=2.1,解得x=0.9,则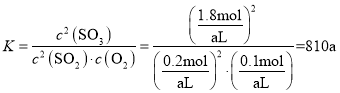 ;
;
(2)由(1)分析可知,反应进行到t1时,SO2的体积分数为![]() ;
;
(3)该反应在恒压装置中进行,充入氩气,氩气不参加反应,因此容器体积将增大,容器内反应物总压将减小,平衡将向气体体积增大的方向移动,即平衡将逆向移动,SO2的物质的量将增大;
(4)该反应正向为放热反应,升高温度,平衡将向吸热反应方向移动,即平衡将逆向移动,达到新平衡混合物中气体的总物质的量大于2.1mol;
(5)恒容条件下,再加入0.2molSO2、0.1molO2和1.8molSO3,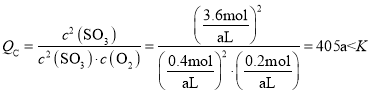 ,反应将正向进行,v逆<v正;
,反应将正向进行,v逆<v正;
(6)由题中表格信息可知,容器2建立的平衡相当于容器1建立平衡后再将容器的容积缩小为原来的![]() (相当于压强增大为原来的2倍)后平衡移动的结果,由于加压,化学反应速率加快,则v1<v2;由于平衡右移,则α1(SO2)<α2(SO2),根据勒夏特列原理可得c2>2c1,p1<p2<2p1;容器3中建立的平衡相当于容器1建立的平衡升温后平衡移动的结果。升高温度,化学反应速率加快,则v1<v3;由于平衡左移,则α1(SO2)>α3(SO2),c1>c3。由于温度升高,气体物质的量增加,故p3>p1。对于特定反应,平衡常数仅与温度有关,温度升高,题给平衡左移,平衡常数减小,则K1=K2>K3,由以上分析可知c2>2c1,p1<p2<2p1,p1<p3,则p2<2p3,v1<v3,α1(SO2)>α3(SO2),因为c2>2c1,c1>c3,则c2>2c3。若容器2的容积是容器1的2倍,则两者建立的平衡完全相同,根据平衡特点,此时应存在α1(SO2)+α2(SO3)=1,由于容器2的平衡相当于容器1的平衡加压,故α2(SO3)将减小,则α1(SO2)+α2(SO3)<1,结合α1(SO2)>α3(SO2),则α2(SO3)+α3(SO2)<1。
(相当于压强增大为原来的2倍)后平衡移动的结果,由于加压,化学反应速率加快,则v1<v2;由于平衡右移,则α1(SO2)<α2(SO2),根据勒夏特列原理可得c2>2c1,p1<p2<2p1;容器3中建立的平衡相当于容器1建立的平衡升温后平衡移动的结果。升高温度,化学反应速率加快,则v1<v3;由于平衡左移,则α1(SO2)>α3(SO2),c1>c3。由于温度升高,气体物质的量增加,故p3>p1。对于特定反应,平衡常数仅与温度有关,温度升高,题给平衡左移,平衡常数减小,则K1=K2>K3,由以上分析可知c2>2c1,p1<p2<2p1,p1<p3,则p2<2p3,v1<v3,α1(SO2)>α3(SO2),因为c2>2c1,c1>c3,则c2>2c3。若容器2的容积是容器1的2倍,则两者建立的平衡完全相同,根据平衡特点,此时应存在α1(SO2)+α2(SO3)=1,由于容器2的平衡相当于容器1的平衡加压,故α2(SO3)将减小,则α1(SO2)+α2(SO3)<1,结合α1(SO2)>α3(SO2),则α2(SO3)+α3(SO2)<1。


科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、![]() )中回收氧化铁流程如图所示:
)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式: _________,指出使用空气比使用氯气好的原因是__________。
(2)已知Fe3+(aq)+3OH-(aq)=Fe(OH)3(s) ΔH=-Q1 kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上Fe3+在该溶液中可存在的最大浓度c(Fe3+)=____________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是________(填化学式,下同),用________试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在一定条件下,容积恒定的反应室中充入amolCO与2amolH2,在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),下列措施一定使c(CH3OH)/c(CO)增大的是
CH3OH(g),下列措施一定使c(CH3OH)/c(CO)增大的是
A. 升高温度
B. 恒温恒容再充入a mol CO和2a mol H2
C. 恒温恒容再充入H2
D. 充入Ar(g)使体系的总压增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
![]()
A.x<yB.SO2是该反应的催化剂
C.MFe2Ox是还原剂D.氧化性:MFe2Oy>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E的合成路线如图:

已知:
①
②
完成下列填空:
(1)B中官能团的名称为_____.C2H4生成C2H5Br的反应类型为____.
(2)C的分子式为_____.
(3)检验C2H5Br分子中含有溴原子的实验方案为____.
(4)E的结构简式为![]() ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
(5)写出一种满足下列条件的有机物的结构简式_____
①分子式只比E少2个氢原子
②与FeCl3发生显色反应
③分子中含有4种不同化学环境的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.碳酸氢钠的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.向明矾溶液中加Ba(OH)2溶液调节pH=12:Al3++SO42-+4OH-+Ba2+═BaSO4↓ +AlO2-+2H2O
C.将锅炉水垢中的硫酸钙用纯碱溶液处理:CaSO4+CO32―=CaCO3+SO42―,
D.Al(OH)3的酸式电离:Al(OH)3=H++AlO2—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.用原子吸收光谱确定物质中含有哪些金属元素
B.在医疗上硫酸铁可用于生产防治缺铁性贫血的药剂
C.在电流作用下,硫酸钠在水溶液中电离成![]() 和
和![]()
D.加入少量铁粉可防止![]() 溶液变质
溶液变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铯(Cs)在自然界中只有一种稳定同位素![]() Cs,核泄漏事故中会产生人工放射性同位素
Cs,核泄漏事故中会产生人工放射性同位素![]() Cs、
Cs、![]() Cs。下列有关说法正确的是
Cs。下列有关说法正确的是
A.铯元素的相对原子质量约为133B.![]() Cs、
Cs、![]() Cs的性质相同
Cs的性质相同
C.![]() Cs的电子数为79D.
Cs的电子数为79D.![]() Cs、
Cs、![]() Cs互为同素异形体
Cs互为同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com