

| A. | 反应开始到10s,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应开始到10s,Y的物质的量的减少是0.79mol | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
分析 A、根据v=$\frac{△c}{△t}$计算化学反应速率;
B、根据平衡图象计算10s,X的物质的量浓度减少;
C、根据平衡图象计算10s,Y的物质的量的减少;
D、根据化学反应中各物质的物质的量变化量与化学计量数之比呈正比书写化学方程式.
解答 解:A.反应开始到10s,用Z表示的反应速率$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),故A错误;
B.反应开始到10s,X的物质的量浓度减少了$\frac{1.2mol-0.41mol}{2L}$=0.0395mol/L,故B错误;
C.反应开始到10s时,Y的物质的量的减少是1.00-0.21=0.79mol,故C正确;
D.由图象可以看出,反应中x、Y的物质的量减少,应为反应物,z的物质的量增多,应为生成物,当反应进行到10s时,△n(X)=0.79mol,△n(Y)=0.79mol,△n(Z)=1.58mol,则△n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为X(g)+Y(g)?2Z(g),故D错误;
故选C.
点评 本题考查化学平衡图象问题,题目难度不大,解题时注意分析图象中各物理量的变化曲线,把握相关物理量的计算.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 由Fe跟S直接化合可得FeS,类推出Cu跟S直接化合可得Cu2S | |
| B. | 金属镁失火不能用CO2灭火,金属钠失火也不能用CO2灭火 | |
| C. | NH4Cl、NH4I结构相似,将两种固体分别加热,分解都只生成卤化氢和氨气 | |
| D. | 原电池中通常是活泼金属做负极,不活泼金属做正极,用镁和铝与NaOH溶液构成原电池时,镁是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 25% | C. | 50% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
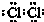 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN变红的溶液中:Na+、Al3+、Cl-、S2- | |
| B. | 1.0 mol?L-1的Na2CO3的溶液中:NH4+、SO32-、Cl-、SO2 | |
| C. | 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 葡萄糖溶液中:Na+、H+、SO42-、Cr2O72- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与FeCl3溶液反应:Cu+2Fe3+═2Fe2++Cu2+ | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com