
 某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.
某化学研究性学习小组在实验室整理化学试剂时,发现一个盛有无色溶液的试剂瓶的标签污损,如右图所示.同学们根据中学化学知识,对该试剂的成分进行了一系列猜想和探究.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
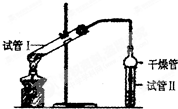 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH| 浓H2SO4 |
| △ |
| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 | |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘水→NaOH溶液→Cu(OH)2溶液 |
| B、H2SO4溶液→碘水→NaOH溶液→Cu(OH)2悬浊液 |
| C、H2SO4溶液→NaOH溶液→碘水→Cu(OH)2悬浊液 |
| D、H2SO4溶液→碘水→Cu(OH)2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 |
| B、钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,进行灼烧,直接观察火焰颜色 |
| C、加入NaOH溶液,加热,放出能使湿润的红色石蕊试纸变蓝的气体,证明一定含有NH4+ |
| D、加入AgNO3溶液,有白色沉淀生成,证明含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所消耗的铜的质量相等 |
| B、所消耗的硝酸的量:②>①>③ |
| C、对环境造成的危害,③最小 |
| D、制取硝酸铜的最佳方案是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
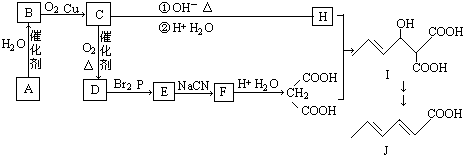
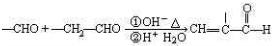
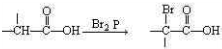
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com