
【题目】下列溶液中微粒的浓度关于不正确的是( )
A.NaClO溶液中:c(Na+)=c(HClO)+c(ClO﹣)
B.等体积、等物质的量浓度的NaX和弱酸HX混合,所得溶液中:c(Na+)>c(X﹣)>c(H+)>c(OH﹣)
C.将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(NH ![]() )>c(Cl﹣)>c(NH3?H2O)>c(OH﹣)>c(H+)
)>c(Cl﹣)>c(NH3?H2O)>c(OH﹣)>c(H+)
D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(Na+)+c(H+)=2c(S2﹣)+c(HS﹣)+c(OH﹣)
【答案】B
【解析】解:A.NaClO溶液中一定满足物料守恒:c(Na+)=c(HClO)+c(ClO﹣),故A正确;B.等体积、等物质的量浓度的NaX和弱酸HX混合,若HX的电离程度大于X﹣的水解程度,则混合液显示酸性,若HX的电离程度小于X﹣的水解程度,则混合液显示碱性,故所得溶液中不一定满足:c(Na+)>c(X﹣)>c(H+)>c(OH﹣),故B错误;
C.将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中溶质为等浓度的氯化铵、一水合氨,一水合氨的电离程度大于铵根离子的水解程度,混合液为碱性,则:c(OH﹣)>c(H+)、c(NH ![]() )>c(Cl﹣)>c(NH3H2O),溶液中各离子浓度大小为:c(NH
)>c(Cl﹣)>c(NH3H2O),溶液中各离子浓度大小为:c(NH ![]() )>c(Cl﹣)>c(NH3H2O)>c(OH﹣)>c(H+),故C正确;
)>c(Cl﹣)>c(NH3H2O)>c(OH﹣)>c(H+),故C正确;
D.0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,根据电荷守恒可得:c(Na+)+c(H+)=2c(S2﹣)+c(HS﹣)+c(OH﹣),故D正确;
故选B.


科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、X是由短周期元素组成的纯净物,其中X为单质.上述物质转化关系如图所示(某些产物略去).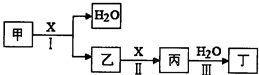
请回答下列问题:
(1)若丁是一元强酸,甲→丁是工业生产丁的主要途径.
①写出反应I的化学方程式:
②常温下,1mol丙发生反应III放出46kJ热量,该反应的热化学方程式为: .
③在常温下,向VIL pH=11的甲溶液中加入V2L pH=3的盐酸,若反应后溶液的pH<7,则V1和V2的关系为V1V2(选填“>”、“<”或“=”),所得溶液中各种离子的浓度由大到小的顺序可能是:(写一种即可).
(2)若丁是二元弱酸,丙是温室气体.
在容积为2L的容积固定的密闭容器中,将乙(g)和H2O(g)按下表用量分别进行反
应:乙(g)+H2O(g)丙(g)+H2(g),得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
乙 | H2O | 丙 | |||
1 | 650 | 4 | 2 | 1.6 | 5 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | 2 | 1 | 0.4 | 1 |
①该反应的正反应为(填“吸热”或“放热”)反应.
②900℃时,上述反应按如下起始量分别加入该容器:
物质 | 乙 | H2O | 丙 | H2 |
起始量/mol | 0.8 | 1.0 | 0.6 | 0.8 |
则此时反应的v(正) v(逆)(填“>”、“<”或“=”).
③实验3跟实验2相比,改变的条件可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门将收集到的一定量酸雨试样分成甲、乙、丙、丁四份,进行如图所示的实验探究。
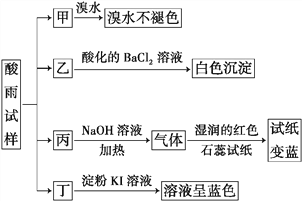
已知酸雨试样中可能含有下表所示的某些离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO32-、Y、NO3- |
请回答下列问题:
(1)X是________________________,Y是__________________________。
(2)可能存在的阴离子是______________________,能证明该阴离子是否存在的简单实验操作为_______________________________________________________________________________________________________________________。
(3)写出丁试样中滴加淀粉KI溶液所发生反应的离子方程式: ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO47H2O的流程如下: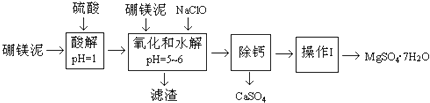
根据题意回答问题:
(1)实验中需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
A.10mL
B.20mL
C.50mL
D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO﹣+H2O→MnO2↓+2H++Cl﹣ , 还有一种离子也会被NaClO氧化,该反应的离子方程式为 .
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 .
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 .
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 . “操作I”是将滤液继续蒸发浓缩,冷却结晶, , 便得到了MgSO47H2O.
(6)实验中提供的硼镁泥共100g,得到的MgSO47H2O为172.2g,则MgSO47H2O的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
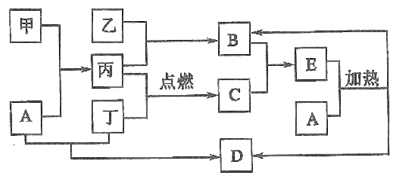
【题目】下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B能使湿润的红色石蕊试纸变为蓝色,丁为黄绿色气体,丙在丁中燃烧产生苍白色火焰,气体B与气体C相遇产生大量的白烟生成E,A是强碱,D是海水中浓度最高的盐(部分反应物和生成物已略去)。
请回答下列问题:
(1)写出工业上由乙与丙生成B的化学方程式:_______________。
(2)写出甲和少量A溶液反应的离子方程式: _______________。
(3)检验E中的阳离子的方法是: _______________。
(4)B物质常见用途:_______________。(任写两条)
(5)某工厂用丁制漂白粉,写出制漂白粉的化学方程式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质用途,用离子方程式解释不正确的是( )
A.氢氟酸刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O
B.明矾用于净水:Al3++3H2O=Al(OH)3+3H+
C.纯碱去除油污:CO32﹣+H2O?HCO ![]() +OH﹣
+OH﹣
D.氯气制备“84”消毒液:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有显著抗癌活性的10﹣羟基喜树碱的结构如图所示,下列关于10﹣羟基喜树碱的说法正确的是( ) 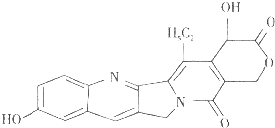
A.分子式为C20H17N2O5
B.该物质可发生消去反应
C.1mol该物质可与9molH2发生加成反应
D.1mol该物质可分别消耗Na、NaOH,Na2CO3的物质的量之比为2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列条件下,两种气体的分子数一定相等的是
A. 同密度、同压强的N2和C2H4 B. 同温度、同体积的O2和N2
C. 同体积、同密度的C2H4和CO D. 同压强、同体积的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碘水中的碘萃取出来的实验中,下列说法错误的是 ( )
A. 分液漏斗使用前要检验它是否漏水
B. 萃取剂要求不溶于水,且比水更容易使碘溶解
C. 注入碘水和萃取剂,倒转分液漏斗反复用力振荡后立即分液
D. 若用苯作萃取剂,则分层后上层液体呈紫红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com