
分析 (1)依据电镀原理分析,钢铁上镀铝是利用铝做阳极,钢铁做阴极,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体做电解液来实现;改用AlCl3水溶液作电解液是溶液中氢离子在阴极放电生成氢气;
①Br2和O2反应得到固体BrO2;A在NaOH水溶液中歧化为NaBr和NaBrO3,据此书写方程式;
②BrF3与水按物质的量之比3:5发生反应,其产物为溴酸、氢氟酸、单质溴和氧气,据此书写方程式;
③根据信息:液态BrF3在20°C时发生了电离存在阴、阳离子,属于有明显离子化合物倾向的盐类来书写.
解答 解:(1)依据电镀原理分析,钢铁上镀铝是利用铝做阳极与电源正极相连,钢铁做阴极与电源负极相连,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体做电解液来实现,离子液体是一种室温熔融盐,为非水体系,电镀过程中不产生其他离子且有机阳离子不参与电极反应,则阴极反应生成铝是发生的还原反应,铝元素化合价降低,分析离子液体成分,结合电荷守恒分析可知是Al2Cl7-得到电子生成,电极反应为:4Al2Cl7-+3e-=Al+7AlCl4-;改用AlCl3水溶液作电解液是溶液中氢离子在阴极放电生成氢气,2H++2e-=H2↑;
故答案为:负;4Al2Cl7-+3e-=Al+7AlCl4-;H2;
①Br2和O2反应得到固体BrO2;A在NaOH水溶液中歧化为NaBr和NaBrO3,方程式为:6BrO2+6NaOH=NaBr+5NaBrO3+3H2O;故答案为:BrO2;6BrO2+6NaOH=NaBr+5NaBrO3+3H2O;
②BrF3与水按物质的量之比3:5发生反应,其产物为溴酸、氢氟酸、单质溴和氧气,根据电子守恒配平方程式为:3BrF3+5H2O=HBrO3+9HF+O2↑,故答案为:3BrF3+5H2O=HBrO3+9HF+O2↑;
③根据信息:液态BrF3在20°C时发生了电离存在阴、阳离子,属于有明显离子化合物倾向的盐类,得到:液态BrF3电离时的阳离子的是BrF2+,阴离子是BrF4-,故答案为:BrF2+;BrF4-.
点评 本题涉及电解池的工作原理以及应用、氧化还原反应知识的迁移应用等知识,属于信息给定题,注意信息的理解和应用是关键,难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. |  根据图可判断可逆反应A2(g)+3B2(g)?2AB3(g),正反应是吸热反应 | |
| B. | 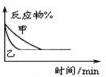 如图表示压强对反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 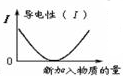 图可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 | |
| D. | 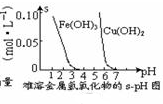 根据图可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在4~5之间即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘的升华、溴水中萃取溴、石油的分馏、煤的干馏均是物理变化 | |
| B. | BaSO4难溶于水是弱电解质,在医学上用作钡餐 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 明矾是常用的净水剂,可以杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
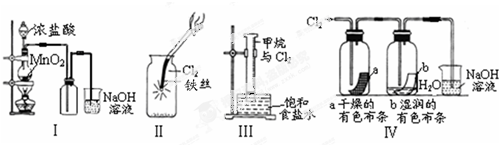
| A. | Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 | |
| B. | Ⅱ图中:有棕黄色的雾生成 | |
| C. | Ⅲ图中:量筒中发生了加成反应 | |
| D. | Ⅳ图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9 g H2O中含有电子数为NA | |
| B. | 11.2 LCl2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是氧化产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | 1mol KClO3参加反应,转移的电子为1mol | |
| D. | H2C2O4的氧化性强于ClO2的氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com