
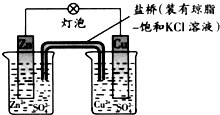
| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 在外电路中,电子从铜片流向锌片 | ||
| C. | 负极发生还原反应 | D. | 盐桥中的K+移向CuSO4溶液 |
分析 铜锌原电池中,锌较活泼,为原电池的负极,负极反应为:Zn-2e-=Zn2+,铜为正极,发生反应为:Cu2++2e-=Cu,原电池工作时,电子从电池负极经外电路流向正极,阳离子移向正极,阴离子移向负极,以此解答该题.
解答 解:A.正极发生还原反应,正确的电极反应式为:Cu2++2e-=Cu,故A错误;
B.电子从电池负极经外电路流向正极,故B错误;
C.负极锌失去电子发生氧化反应,故C错误;
D.电解质溶液中阳离子移向正极,阴离子移向负极,则盐桥中K+移向CuSO4溶液,故D正确;
故选D.
点评 本题考查原电池工作原理,题目难度不大,明确原电池工作原理为解答关键,注意把握原电池两极的判断方法及电极方程式的书写,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:推断题
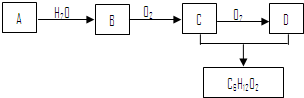
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是烃 | B. | 不能在空气中燃烧 | ||
| C. | 常温下呈固态 | D. | 可能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
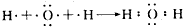 .
.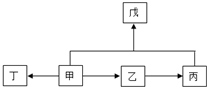 (3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系:
(3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系: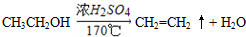 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
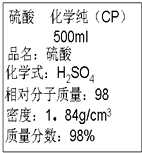
| A. | 该硫酸的物质的量浓度为9.2 mol•L-1 | |
| B. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸25 mL | |
| C. | 该硫酸与等体积的水混合后所得溶液浓度为9.2 mol•L-1 | |
| D. | 该硫酸与等体积水混合后质量分数大于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )| A. | Y元素的两种同素异形体在常温下都是气体 | |
| B. | 原子半径由大到小排列顺序Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性W>Z | |
| D. | 阴离子半径由大到小排列顺序X>Y>Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
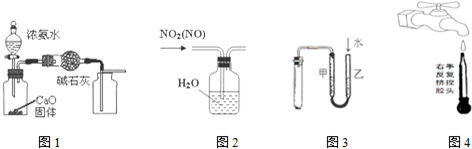
| A. | 用图1装置制取并收集干燥纯净的NH3 | |
| B. | 用图2所示装置可除去NO2中的NO | |
| C. | 用图3所示装置检验装置的气密性 | |
| D. | 图④是实验室洗涤胶头滴管的操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
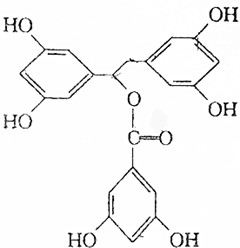 某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )| A. | 7:9:9 | B. | 8:9:9 | C. | 7:10:9 | D. | 7:9:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com