
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)>c(H+) |
| C、0.1mol?L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| D、0.1mol?L-1的硫化钠溶液中:c(OH-)=c(H+)>c(HS-)>c(H2S) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、容量瓶中原有少量蒸馏水 |
| B、溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C、定容时观察液面俯视 |
| D、称取胆矾80g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2.9g C2H
| ||
| B、标准状况下,22.4L乙酸的分子数为NA个 | ||
| C、一个氯原子的质量是35.5NAg | ||
| D、铝与氢氧化钠溶液反应,每生成1mol氢气,铝就失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O |
| B、碳酸钙与盐酸反应:CaCO3+2H+→Ca2++CO2↑+H2O |
| C、锌粉溶解于醋酸:Zn+2H+→Zn2++H2↑ |
| D、硫酸镁溶液跟氢氧化钡溶液反应:Mg2++SO42-+Ba2++2OH-→BaSO4↓+Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2KBr═Br2+2KCl | ||||
B、CaCO3
| ||||
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||||
D、2CuO+2CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B |
 制备并收集氨气 |  验证铁的吸氧腐蚀 |
| C | D |
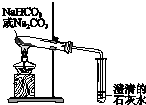 鉴别碳酸钠与碳酸氢钠 | 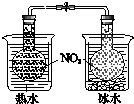 证明温度对平衡移动的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
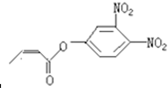 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )| A、遇FeCl3溶液均显紫色 |
| B、均能发生银镜反应 |
| C、均能与溴水发生反应 |
| D、均能与NaOH溶液发生反应下列 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 物质 | 0℃ | 50℃ | 80℃ |
| Ca(0H)2 | 0.173 | 0.130 | 0.004 |
| Ba(OH)2 | 1.64 | 13.1 | 101.5 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com