
| 选项 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
| A | 水煤气 | 大理石 | 苛性钠 | 醋酸 | 二氧化碳 |
| B | 胆矾 | 空气 | 硫酸钠 | 一水合氨 | 石墨 |
| C | 生石灰 | 水煤气 | 盐酸 | 碳酸 | 铜 |
| D | 烧碱 | 汽油 | 硫酸钡 | 水 | 乙醇 |
| A、A | B、B | C、C | D、D |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
| A、氧化还原反应中一定有化合价的升降 |
| B、有氧元素参加的反应一定是氧化还原反应 |
| C、氧化剂在反应中失去电子 |
| D、还原剂在反应中化合价升高,被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-═Al(OH)3 |
| B、以KOH溶液为电解质溶液的氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、测0.1mol/L氨水的pH为11:NH3?H2O?NH4++OH- |
| D、钢铁发生吸氧腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
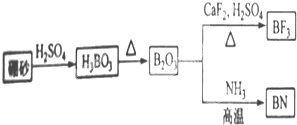
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性 |
| B、由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物 |
| C、基态C原子有两个未成对电子,所以最多只能形成2个共价键 |
| D、所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com