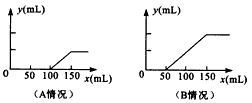解:CO
2与NaOH溶液反应有如下两种“边界”情况:
CO
2+2NaOH=Na
2CO
3+H
2O…①
CO
2+NaOH=NaHCO
3…②
故反应后溶液中溶质的成分可有如下可能:Na
2CO
3和NaOH、Na
2CO
3、Na
2CO
3和NaHCO
3、NaHCO
3;
当将稀盐酸逐滴滴到碳酸钠溶液中时,Na
2CO
3跟盐酸的反应是分步进行的:
Na
2CO
3+HCl=NaHCO
3+NaCl…③
NaHCO
3+HCl=NaCl+H
2O+CO
2↑…④
并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等.
若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H
2O…⑤
设反应产生CO
2 之前消耗盐酸的体积为V
1,从开始产生CO
2 至反应结束消耗盐酸的体积为V
2.
将各种反应的情况总结如下表:
| 溶液中溶质的成分 | Na2CO3和NaOH | Na2CO3 | Na2CO3和NaHCO3 | NaHCO3 | NaHCO3 |
| 向溶液中逐滴加入稀盐酸发生的反应 | 依次是⑤③④ | 依次是③④ | 依次是③④ | ④ | ④ |
| V1与V2的关系 | V1>V2 | V1=V2 | V1<V2 | V1=0,V2>0 | V1=0,V2>0 |
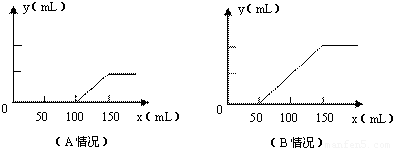
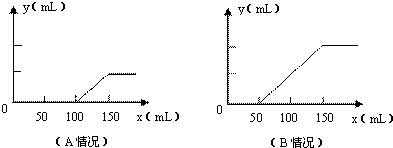
分析题中的图象:
(1)对于A图,V
1=100mL,V
2=150mL-100mL=50mL<V
1,据此判断溶液中溶质的成分是Na
2CO
3和NaOH.
根据上面⑤③④三个化学方程式可知,NaOH和Na
2CO
3的物质的量之比等于消耗盐酸的体积之比,则
n(NaOH):n(Na
2CO
3)=(100mL-50mL):50mL=1:1.
故答案为:Na
2CO
3和NaOH;1:1;
(2)对于B图,V
1=50mL,V
2=100mL.V
1<V
2.溶液中溶质的成分是Na
2CO
3和NaHCO
3.
根据上面③④两个反应的化学方程式可知:NaHCO
3和Na
2CO
3的物质的量之比等于两个过程分别消耗盐酸的体积之比:
n(NaHCO
3):n(Na
2CO
3)=(150mL-50mL-50mL):50mL=1:1.
故答案为:Na
2CO
3和NaHCO
3;1:1;
(3)完全反应后,溶液溶质的成分为NaCl,根据质量守恒可知:
取出20mL溶液:n(NaOH)=n(HCl)=0.15L×0.2mol/L=0.03mol,
所以100mLNaOH中溶液中n(NaOH)=0.15mol,
c(NaOH)=
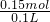
=1.5mol/L,
故答案为:1.5 mol?L
-1.
分析:CO
2与NaOH溶液反应有如下两种“边界”情况:
CO
2+2NaOH=Na
2CO
3+H
2O…①
CO
2+NaOH=NaHCO
3…②
故反应后溶液中溶质的成分可有如下可能:Na
2CO
3和NaOH、Na
2CO
3、Na
2CO
3和NaHCO
3、NaHCO
3;
当将稀盐酸逐滴滴到碳酸钠溶液中时,Na
2CO
3跟盐酸的反应是分步进行的:
Na
2CO
3+HCl=NaHCO
3+NaCl…③
NaHCO
3+HCl=NaCl+H
2O+CO
2↑…④
并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等.
若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H
2O…⑤
根据反应的化学方程式结合消耗盐酸的体积进行计算.
点评:本题考查混合物的计算,题目难度较大,注意从图象分析反应可能的情况进行判断和计算.

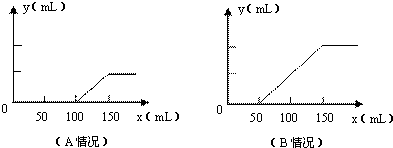
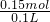 =1.5mol/L,
=1.5mol/L,

 过氧化氢很重要的研究和应用价值.
过氧化氢很重要的研究和应用价值.