
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将化学能转变为电能的装置叫做原电池 | |
| B. | 乙醇和沼气都是可再生能源 | |
| C. | CO2是造成酸雨的主要原因之一 | |
| D. | 质子数相同而中子数不同的同一元素的不同原子互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
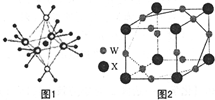 现有A、X、Y、Z、W五种元素,它们的原子序数依次增大.A原子的核外总数与其周期数相同;X基态原子的L电子层中有3个未成对电子;Y基态原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;Z基态原子的3p轨道上得到两个电子后不能再容纳外来电子;W基态原子的最外层电子数为1,其余各电子层均充电子层均充满电子.请回答下列问题:
现有A、X、Y、Z、W五种元素,它们的原子序数依次增大.A原子的核外总数与其周期数相同;X基态原子的L电子层中有3个未成对电子;Y基态原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;Z基态原子的3p轨道上得到两个电子后不能再容纳外来电子;W基态原子的最外层电子数为1,其余各电子层均充电子层均充满电子.请回答下列问题: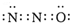 ,其中心原子的杂化轨道类型是sp,1molX2Y含有的π键数目为2NA.
,其中心原子的杂化轨道类型是sp,1molX2Y含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入盐酸溶液 HCl+NH3═NH4Cl | |
| B. | 澄清的石灰水跟盐酸反应 H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应 Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
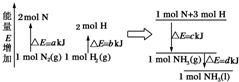 化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,(注:图中△E都为正值),写出该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1.
化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,(注:图中△E都为正值),写出该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Y>Z | B. | 氢化物的稳定性:X>W | ||
| C. | 离子的还原性:X>W | D. | 离子半径:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com