
| A. | 两溶液的导电能力和pH值均相同 | |
| B. | 中和两溶液,消耗NaOH的物质的量相同 | |
| C. | 分别与足量的Zn完全反应,盐酸产生的速率快,氢气多 | |
| D. | 当把两种酸各10mL混合后,加10mL 0.1mol•L-1的NaOH,则有c(H+)=c(CH3COO-) |
分析 浓度均为0.1mol.L-1的HC1和CH3COOH,HCl完全电离,溶液中c(H+)=0.1mol/L,CH3COOH是弱电解质部分电离,溶于中c(H+)<0.1mol/L,据此分析.
解答 解:A.浓度均为0.1mol.L-1的HC1和CH3COOH,CH3COOHc(H+)小,所以两个溶液的导电能力和pH值都不相同,故A错误;
B.浓度均为0.1mol.L-1的HC1和CH3COOH,体积均为10mL,则两种酸的物质的量相同,反应消耗的NaOH相同,故B正确;
C.两种酸的物质的量相同,与Zn反应生成的氢气的体积相同,故C错误;
D.HC1与NaOH恰好反应生成NaCl,CH3COOH过量,CH3COOH部分电离,水也有小部分电离,所以c(H+)>c(CH3COO-),故D错误.
故选B.
点评 本题考查了弱电解质的电离及溶液中离子浓度定性比较,题目难度中等,注意掌握酸碱混合后溶液酸碱性的判断方法,明确电荷守恒、物料守恒的含义,试题培养了学生的灵活应用能力.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:实验题
 NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 过氧化钠与水反应:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.5 | B. | 17 | C. | 22 | D. | 34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ K+ SO42- AlO2- | B. | Ca2+ Na+ SO42- Cl- | ||
| C. | Na+ K+ SO42- NO3- | D. | K+ Na+ MnO4- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O | C. | NO2 | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
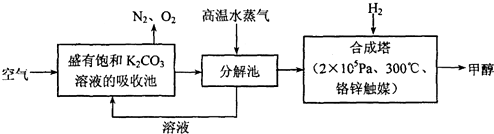
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
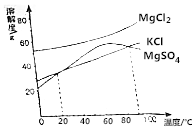 我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.
我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com