
【题目】甲醛在木材加工、医药等方面有重要用途。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)HCHO(g)+H2(g) △H1=+92.09kJ·mol-1
氧化法:CH3OH(g)+1/2O2(g)HCHO(g)+H2O(g) △H2
(1)脱氢法制甲醛,有利于提高平衡产率的条件有____________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJ·mol-1,则△H2=________。
(3)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应CH3OH(g)HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(4)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→·H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
如图所示为在体积为1L的恒容容器中,投入1molCH3OH,在碳酸钠催化剂作用下,经过5min反应,测得甲醇的转化率(X)与甲醛的选择性(S)与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比),回答下列问题:
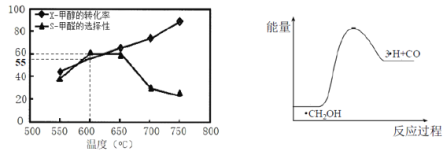
①600℃时,5min内甲醛的反应速率为____________。
②650℃-750℃甲醛选择性随温度下降,而甲醇转化率随温度升高的可能原因为________;
③700℃时,历程iii能量~反应过程如图所示,在答卷纸上绘制历程ii的“能量~反应过程”示意图。___________
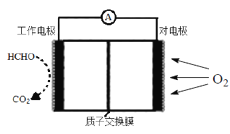
II.室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理所示,则工作电极的电极反应式为_____________。
【答案】BC -149.73kJ·mol-1 50.5kPa 0.066mol·L-1·min-1 反应CH3OHCO+2H2为吸热反应,温度升高平衡正移,CH3OH转化率提高;或该反应随温度升高反应速率加快,CH3OH转化率提高  HCHO-4e-+H2O=CO2+4H+
HCHO-4e-+H2O=CO2+4H+
【解析】
I.(1)该反应是一个反应前后气体体积增大的吸热反应,减小压强、升高温度都能增大反应物转化率;
(2)根据盖斯定律分析解答;
(3)恒温恒容条件下,压强之比等于其物质的量之比,根据方程式,结合甲醇的转化率计算平衡时的压强和三种气体分压,再结合反应的平衡常数Kp= 计算;
计算;
(4)①600℃时,5min内甲醇的转化率为55%,根据C原子守恒得n(HCHO) =n(CH3OH)(消耗)×60%=1mol×55%×60%=0.33mol,据此计算v(HCHO);②升高温度平衡向吸热方向移动;③ii为分解反应,是吸热反应,H原子和CO生成甲醛的反应为放热反应,所以反应ii产物总能量小于反应iii产物总能量;
II.反应中C元素化合价由0价变为+4价,则工作电极为负极,负极上HCHO失电子发生氧化反应。
I.(1) 脱氢法制甲醛的反应为CH3OH(g)HCHO(g)+H2(g) △H1=+92.09kJ·mol-1,该反应是一个反应前后气体体积增大的吸热反应,减小压强、升高温度都能使平衡正向移动,从而增大反应物转化率,所以提高平衡产率的条件为高温、低压,故选BC;
(2)i.CH3OH(g)HCHO(g)+H2(g) △H1=+92.09kJmol-1,ii.2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJmol-1,根据盖斯定律,将方程式i+![]() ii得方程式CH3OH(g)+
ii得方程式CH3OH(g)+![]() O2(g)HCHO(g)+H2O(g) △H2=(+92.09-
O2(g)HCHO(g)+H2O(g) △H2=(+92.09-![]() ×483.64)kJ/mol=-149.73kJmol-1,故答案为:-149.73kJmol-1;
×483.64)kJ/mol=-149.73kJmol-1,故答案为:-149.73kJmol-1;
(3)恒温恒容条件下,压强之比等于其物质的量之比,设开始时n(CH3OH)=amol,达到平衡状态时甲醇的转化率为50%,则平衡时n(CH3OH)=amol×(1-50%)=0.5amol,根据方程式CH3OH(g)HCHO(g)+H2(g)知,平衡时生成的n(HCHO)=n(H2)=0.5amol,则平衡时混合气体总物质的量=(0.5+0.5+0.5)amol=1.5amol,平衡时压强P=![]() ×101kPa=1.5×101kPa,三种气体分压相等,P(CH3OH)=P(HCHO)=P(H2O)=
×101kPa=1.5×101kPa,三种气体分压相等,P(CH3OH)=P(HCHO)=P(H2O)=![]() ×1.5×101kPa=0.5×101kPa,反应的平衡常数Kp=
×1.5×101kPa=0.5×101kPa,反应的平衡常数Kp= =
=![]() =50.5kPa,故答案为:50.5kPa;
=50.5kPa,故答案为:50.5kPa;
(4)①600℃时,5min内甲醇的转化率为55%,根据C原子守恒得n(HCHO)=n(CH3OH)(消耗)×60%=1mol×55%×60%=0.33mol,v(HCHO)=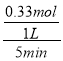 =0.066 molL-1min-1,故答案为:0.066 molL-1min-1;
=0.066 molL-1min-1,故答案为:0.066 molL-1min-1;
②升高温度平衡向吸热方向移动,反应CH3OHCO+2H2为吸热反应,温度升高平衡正移,CH3OH转化率提高;或该反应随温度升高反应速率加快,CH3OH转化率提高,故答案为:反应CH3OHCO+2H2为吸热反应,温度升高平衡正移,CH3OH转化率提高;或该反应随温度升高反应速率加快,CH3OH转化率提高;
③ii为分解反应,是吸热反应,H原子和CO生成甲醛的反应为放热反应,所以反应ii产物总能量小于反应iii产物总能量,所以其图像为 ,故答案为:
,故答案为: ;
;
II.根据工作原理图,反应中HCHO 中C元素化合价由0价变为+4价,则工作电极为负极,负极上HCHO失电子发生氧化反应,电极反应式为HCHO-4e-+H2O=CO2+4H+,故答案为:HCHO-4e-+H2O=CO2+4H+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
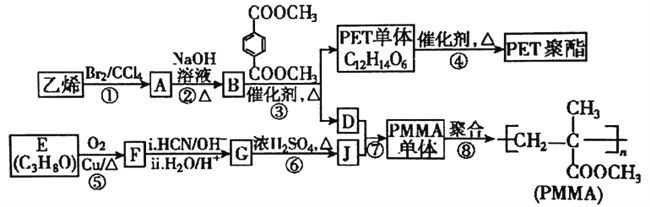
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下图:
已知:
I.RCOOR+R "OH![]() RCOOR "+ROH (R.R'、R"代表烃基)
RCOOR "+ROH (R.R'、R"代表烃基)
II.  (R代表烃基)。
(R代表烃基)。
(1)PMMA单体的结构简式为_______,PET单体中的官能团名称为________。
(2)反应⑤的反应类型是________;反应②的化学方程式为_________。
(3)若反应④得到的某一条链状产物聚合度为n,则缩聚反应中脱去的小分子有(___)个。
(4)PMMA单体有多种同分异构体,某种异构体K具有如下性质:①不能发生银镜反应②不能使溴水褪色③分子内没有环状结构④核磁共振氢谱有面积比为3:1的两种峰,则K的结构简式为:__________;另一种异构体H含有醛基、羟基和碳碳双键,在铜催化下氧化,官能团种类会减少一种,则H合理的结构共有___种(不考虑立体异构和空间异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
② R-CH=CH2![]() R-CH2-CH2-Br
R-CH2-CH2-Br
香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。
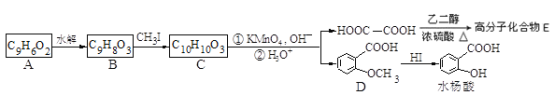
请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是___________
a. C中核磁共振氢谱共有8种峰
b. A、B、C均可发生加聚反应
c. 1mol A最多能和5mol氢气发生加成反应
d. B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为______和______(填官能团名称),B→C的反应类型为_____________。
(3)在上述转化过程中,反应步骤B→C的目的是_________________________。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:_____________。
(5)写出合成高分子化合物E的化学反应方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用少量的溴和足量的乙醇制备1,2—二溴乙烷,反应原理为:CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:
CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:

下列说法中不正确的是( )
A. 使用恒压低液漏斗的目的是防止有机物挥发,使漏斗内液体顺利滴下
B. 实验中为了防止有机物大量挥发,应缓慢升高反应温度至170℃
C. 装置C中应加入氢氧化钠溶液,以吸收反应中可能生成的酸性气体
D. 实验过程中应用冷水冷却装置D,以避免溴的大量挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
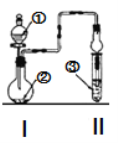
① | ② | ③ | II中实验现象 | |
A | 浓盐酸 | 大理石 | 氯化钡溶液 | 产生大量白色沉淀 |
B | 浓氨水 | 碱石灰 | 硫酸亚铁溶液 | 产生大量白色沉淀 |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 |
D | 浓盐酸 | KMnO4 | 氢硫酸 | 产生淡黄色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为__________________,得到滤渣 1的主要成分为_______________。
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是____________________。
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式______________。
(4)第③步蒸发所需玻璃仪器为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间有如下转化关系: 下列有关物质的推断不正确的是 ( )
下列有关物质的推断不正确的是 ( )
A. 若甲为AlC13溶液,则丁可能是NaOH溶液 B. 若甲为N2,则丁可能是O2
C. 若甲为Fe,则丁可能是稀硝酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法正确的是( )
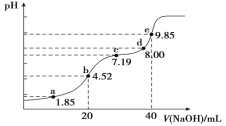
A.a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1 mol/L
B.b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C.c点所得溶液中:c(Na+)>3c(HSO3-)
D.d点所得溶液中:c(Na+)>c(OH-) >c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com