
 将水分解制得氢气的一种工业方法是“硫-碘循环法”,依次涉及下列三步反应:
将水分解制得氢气的一种工业方法是“硫-碘循环法”,依次涉及下列三步反应:分析 (1)由图可知,平衡时氢气的物质的量为0.1mol,根据方程式计算参加反应的HI的物质的量,可计算v(HI),相同温度下,若起始加入的HI改为2mol,相当于增大压强,平衡不移动,反应达平衡时H2的量为原平衡的2倍;
(2)总反应为2H2O$\frac{\underline{\;催化剂\;}}{\;}$2H2+O2,整个分解水的过程中SO2和I2相当于催化剂.
解答 解:(1)方程式为2HI(g)?H2(g)+I2(g),平衡时氢气的物质的量为0.1mol,则消耗0.2molHI,0~2min内的平均反应速率v(HI)=$\frac{\frac{0.2mol}{5L}}{2min}$=0.02moL/(L•min),
相同温度下,若起始加入的HI改为2mol,相当于增大压强,平衡不移动,反应达平衡时H2的量为原平衡的2倍,应为0.2mol,
故答案为:0.02moL/(L•min);0.2;
(2)a.三步反应都涉及到单质,存在元素化合价的变化,均为氧化还原反应,故a正确;
b.总反应为2H2O$\frac{\underline{\;催化剂\;}}{\;}$2H2+O2,循环过程中产生1molH2,同时产生0.5molO2,故b错误;
c.将Ⅰ+Ⅱ+Ⅲ×$\frac{1}{2}$可得H2O$\frac{\underline{\;催化剂\;}}{\;}$H2+$\frac{1}{2}$O2,在整个分解水的过程中SO2和I2相当于催化剂,故c正确.
故答案为:b.
点评 本题综合考查物质的量随时间的变化曲线,为高频考点,侧重考查学生的分析能力,难度中等,是对基础知识的综合利用,注意对知识的全面掌握,注意把握反应原理的分析.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
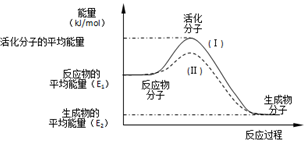 在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.
在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 烷烃的同系物可用通式CnH2n+2表示 | |
| B. | 同系物的化学性质相似 | |
| C. | 同系物的物理性质相同 | |
| D. | 同分异构体的化学性质一定不相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的液态单质可在医疗上用于冷冻麻醉 | |
| B. | Y、M两元素气态氢化物的稳定性:Y<M | |
| C. | 工业上制备Z的单质可电解其熔融态的氧化物 | |
| D. | 氧化物XO2与MO2均具有漂白性,且漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z既能形成离子化合物.又能形成共价化合物 | |
| B. | Y和Z元素的原子半径大小顺序为Y>Z | |
| C. | X与Y、Z之问形成的核外电子总数为10的微粒只有YX3和X2Z | |
| D. | Z、W元索的最简单氢化物的沸点和稳定性均为H2Z>H2W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲为C,X为O2 | B. | 甲为SO2,X为NaOH溶液 | ||
| C. | 甲为Fe,X为Cl2 | D. | 甲为硝酸溶液,X为Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | 铁粉具有还原性 | 袋装食品的抗氧剂 |
| B | 铁离子的氧化性比铜离子强 | FeCl3溶液腐蚀Cu刻制印刷电路板 |
| C | Na2O2能与CO2反应生成氧气 | 呼吸面具中的氧气来源 |
| D | SO2具有漂白性 | 豆芽菜、银耳等食品的漂白 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
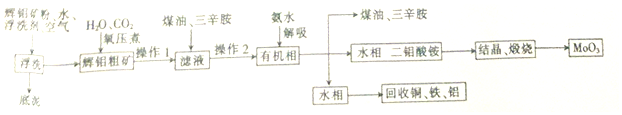
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
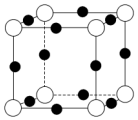 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题: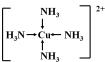 (用箭头表示出提供孤对电子的原子).将 F 单质的粉末加入A的气态氢化物的水化物浓溶液中,通入 O2,充分反应后溶液呈深蓝色,该反应的离子方程式为2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.
(用箭头表示出提供孤对电子的原子).将 F 单质的粉末加入A的气态氢化物的水化物浓溶液中,通入 O2,充分反应后溶液呈深蓝色,该反应的离子方程式为2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com