
| A. | 64gCaC2中含有的共用电子对数为3NA | |
| B. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| C. | 4.6gNO2在标准状况下,含有的分子数为0.1NA | |
| D. | 50mL12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A.CaC2中C22-的电子式为 ,故1molCaC2含3mol共用电子对,64gCaC2的物质的量为$\frac{64g}{64g/mol}$=1mol,故含3mol共用电子对,即3NA电子对;
,故1molCaC2含3mol共用电子对,64gCaC2的物质的量为$\frac{64g}{64g/mol}$=1mol,故含3mol共用电子对,即3NA电子对;
B.己烷标准状况下不是气体;
C.NO2不稳定极易转化为N2O4,即2NO2?N2O4存在这样的动态平衡,故无法求其分子数;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应.
解答 解:A.CaC2中C22-的电子式为 ,故1molCaC2含3mol共用电子对,64gCaC2的物质的量为$\frac{64g}{64g/mol}$=1mol,故含3mol共用电子对,即3NA电子对,故A正确;
,故1molCaC2含3mol共用电子对,64gCaC2的物质的量为$\frac{64g}{64g/mol}$=1mol,故含3mol共用电子对,即3NA电子对,故A正确;
B.标准状况下,11.2L己烷不是气体,故B错误;
C.NO2不稳定极易转化为N2O4,即2NO2?N2O4存在这样的动态平衡,故无法求其分子数,故C错误;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故盐酸不能反应完全,则转移的电子数小于0.3NA个,故D错误,
故选A.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量与物理量之间的转化关系,明确标况下气体摩尔体积的使用条件.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 试剂X | 离子方程式 |
| A | Fe3+、Al3+、SiO32-、NO3- | 过量的盐酸 | SiO32-+2H+=H2SiO3↓ |
| B | 透明溶液中:Fe3+、NH4+、SO42-、Cl- | 过量的铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| C | Na+、Ba+、HCO3-、Cl- | NaHSO4溶液 | H++HCO3-=CO2↑+H2O |
| D | pH=1的溶液中:Mg2+、Fe2+、NO3-、SO42- | 双氧水 | 2Fe2++H2O2+2H+=2Fe3++2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R可能为乙二酸 | |
| B. | N可能为对苯二甲酸 | |
| C. | 高聚物M为加聚产物 | |
| D. | 含有羧基的物质在常温下均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
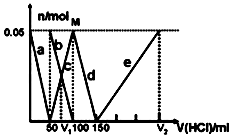 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O | |
| B. | M点时生成的CO2为0.05mol | |
| C. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| D. | V1:V2=1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:| 号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料n | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积/L | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | v甲 | v乙 | v丙 |
| A. | V甲>V乙 | B. | K丙>K乙 | C. | V甲=V丙 | D. | c乙>c甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中的氧化剂只有Cu2O | |
| B. | Cu2S在反应中既是氧化剂又是还原剂 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 生成1 mol Cu,转移2 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com