


分析 (1)海水淡化即利用海水脱盐生产淡水的过程,常见的方法有:蒸馏法、离子交换法、电渗析法等;减压时,水的沸点降低,节约能源;
(2)阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;在电渗析法淡化海水示意图中阴离子移向阳极,阴离子移向阳极,离子浓度小的为淡水;
(3)①海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴,氯气和溴离子反应生成溴单质;通入二氧化硫,溴与二氧化硫水溶液反应生成硫酸和溴化氢,在氯水溶液中重新得到溴单质,富集溴元素,萃取蒸馏得到溴单质;
②氯化镁水解显酸性,如果直接在空气中加热MgCl2•6H2O则Mg2+会水解的生成Mg(OH)Cl和HCl,氯化氢气流中加热防止水解.
解答 解:(1)淡化海水,应将水与盐分离,常见淡化海水的方法有蒸馏法、离子交换法、电渗析法等,用蒸馏法淡化海水,减压时,水的沸点降低,能够节约能源,
故答案为:离子交换法;电渗析法;降低海水的沸点,节约能源;
(2)分析装置图,阴极室电极和电源负极相连,a为电源负极;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,①室离子浓度变小,所以淡水从Ⅰ口排出的是流出,
故答案为:负;淡水;
(3)①海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程,氯气和溴离子反应生成溴单质,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-;通入二氧化硫富集溴元素;溴与二氧化硫水溶液反应生成硫酸和溴化氢,反应的化学方程式SO2+Br2+2H2O=2HBr+H2SO4,在氯水溶液中重新得到溴单质,富集溴元素,萃取蒸馏得到溴单质,
故答案为:萃取;蒸馏;SO2+Br2+2H2O=2HBr+H2SO4;
②如果直接在空气中加热MgCl2•6H2O则Mg2+会水解的生成Mg(OH)Cl和HCl,其反应方程式为:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O,通入HCl,氯化氢气流中加热防止水解,
故答案为:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O;氯化氢气流中加热.
点评 本题考查了海水淡化原理,明确图片内涵是解本题关键,注意电解、盐类水解原理、实验基本操作的灵活应用,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
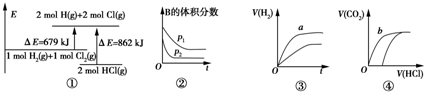
| A. | ①表示化学反应H2(g)+Cl2(g)═2HCl(g)的能量变化,则该反应的反应热△H=+183 kJ/mol | |
| B. | ②表示其他条件不变时,反应4A(g)+3B(g)═2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体 | |
| C. | ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
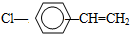 ,该有机物能发生( )
,该有机物能发生( )| A. | 只有③⑥不能发生 | B. | 只有⑥不能发生 | ||
| C. | 只有①不能发生 | D. | 以上反应均可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②③④ | C. | ①④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洪灾区民众用明矾净水并用漂白粉消毒,二者化学原理相同 | |
| B. | 燃煤发电厂在煤燃烧时加入一些生石灰,能减少废气中的二氧化硫排放 | |
| C. | 洗涤脱排油烟机表面的油脂污物时,热的纯碱溶液比冷的去污效果好 | |
| D. | 通讯领域中的光导纤维不可长期浸泡在强碱性溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢管与铅连接,钢管可被保护 | |
| B. | 铁遇冷浓硫酸表面钝化,可保护内部不被腐蚀 | |
| C. | 纯铁比生铁更容易被腐蚀 | |
| D. | 钢铁发生析氢腐蚀时,负极反应是Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 乙烯在一定条件下能发生加成反应,加聚反应,被酸化高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1价 | B. | +2价 | C. | +3价 | D. | +4价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
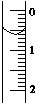 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com