
 在恒容密闭容器中加入一定量的反应物后存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法错误的是( )
在恒容密闭容器中加入一定量的反应物后存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法错误的是( )| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在T2时,D点的反应速率:ν(逆)>ν(正) | |
| C. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
分析 A、由图可知,温度越高平衡时c(CO2)越大,说明升高温度平衡向正反应移动;
B、T2时反应进行到状态D,c(CO2)高于平衡浓度,故反应向逆反应进行;
C、根据温度对平衡的影响,分析CO的浓度;
D、化学平衡常数只受温度影响,升高温度平衡向吸热反应移动,根据平衡移动判断温度对平衡常数的影响.
解答 解:A、由图可知,温度越高平衡时c(CO2)越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故正反应是吸热反应,即△H>0,故A正确;
B、T2时反应进行到状态D,c(CO2)高于平衡浓度,故反应向逆反应进行,则一定有υ(正)<υ(逆),故B正确;
C、平衡状态A与C相比,C点温度高,已知△H>0,升高温度平衡正移,CO浓度减小,所以A点CO浓度大,故C错误,
D、该反应正反应是吸热反应,升高温度平衡向正反应移动,化学平衡常数增大,故K1<K2,故D正确;
故选C.
点评 本题考查温度对平衡移动的影响、对化学平衡常数的影响等,难度中等,注意曲线的各点都处于平衡状态.


科目:高中化学 来源: 题型:解答题
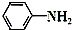 +CH3COOH$\stackrel{△}{→}$
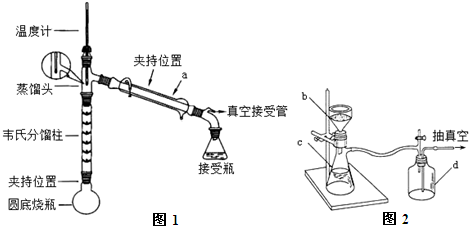
+CH3COOH$\stackrel{△}{→}$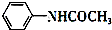 +H2O
+H2O| 试剂名称 | 熔点℃ | 沸点℃ | 溶解度(20℃) |
| 苯胺 | -6.2 | 184.4 | 稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 | 16.7 | 118 | 易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 114~116 | 280~290 | 0.46g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{V•d}{MV+2240}$mol/L | B. | $\frac{M•V}{2240(V+0.1)d}$mol/L | ||
| C. | $\frac{100V•d•M}{MV+2240}$mol/L | D. | $\frac{1000V•d}{MV+2240}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 混合气体的平均相对分子质量 | D. | $\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仍在中间 | B. | 偏向左盘 | C. | 偏向右盘 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
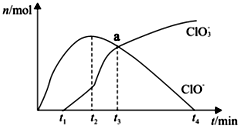 工业上将Cl 2通入冷的NaOH溶液中制得漂白液 (主要成分是NaClO ),室温下将Cl 2缓缓通入NaOH溶液中,得到ClO -、ClO 3-的物质的量与反应时间的关系如图所示,下列有关说法正确的是( )
工业上将Cl 2通入冷的NaOH溶液中制得漂白液 (主要成分是NaClO ),室温下将Cl 2缓缓通入NaOH溶液中,得到ClO -、ClO 3-的物质的量与反应时间的关系如图所示,下列有关说法正确的是( )| A. | HClO具有强氧化性,而NaClO没有氧化性 | |
| B. | 向漂白液中加入足量浓盐酸可增强漂白效果 | |
| C. | 无法求出a点时的溶液中,c( Na+ )和 c(Cl-)的比值 | |
| D. | t 2到t 4,n( ClO - )下降的原因可能是:3ClO -═2Cl-+ClO 3 - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1| 温度/K | 反应I | 反应II | 已知: K2>K1 >K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com