
����Ŀ�����������������ؾ���(K3[Fe(C2O4)3]��3H2O)������ˮ���������Ҵ����������Թ����У������¼������ֽ⡣���������������Ʊ�����������������и��⣺

��1���ܽ�ʱ��ϡ�����������__________________________
��2�����ܽ�Һ����һ�����IJ��������У��γɻ�ɫ���������ˣ�ϴ�ӡ�
������ͼ�ǹ���װ��ͼ��ָ��ͼ���������Դ���һ����_____________________����һ����©�����¼��û�н������ܵ��ձ���

�����ȷ�������Ѿ�ϴ�Ӹɾ�____________________________________��
��3�����������г����Ͻ����⣬ά���¶���40�����ң�ԭ����___________________________��
��4��д�������������������������ص����ӷ���ʽ__________________________________��
��5�����������������ؾ�������¼��ɷֽ��������ֲ����Ρ�CO2�ȡ�д���÷ֽⷴӦ�Ļ�ѧ����ʽ______________________��
���𰸡� ����Fe2+��ˮ�� δʹ�ò��������� ȡ����ϴ��Һ�������еμ������ữ���Ȼ�����Һ����������ɫ����������ϴ�Ӹɾ� �¶�̫�ͷ�Ӧ���������¶ȸ߹��������ֽ� 2FeC2O4��2H2O+H2O2+H2C2O4+3C2O42-=2[Fe(C2O4)3]3-+6H2O 2K3[Fe(C2O4)3]��3H2O![]() 3K2C2O4+2FeC2O4+2CO2��+6H2O
3K2C2O4+2FeC2O4+2CO2��+6H2O
�������������������1������������ˮ������ԣ�����������Է�ֹˮ�⣻��2����������Ҫ�ò�����������������ϴ�Ӹɾ���ϴ��Һ�в���SO42-�����Ը���ϴ��Һ���Ƿ���SO42-�ж��Ƿ�ϴ�Ӹɾ�����3���¶�̫�ͷ�Ӧ���������¶ȸ߹��������ֽ�����4����������FeC2O4��2H2O��H2O2��H2C2O4��K2C2O4�������������(��)�������5�����������(��)��ؾ�������¼��ɷֽ�����CO2������������ԭ��Ӧ���ɣ����ɵIJ�������K2C2O4��FeC2O4��
��������1������������ˮ������ԣ�������������Fe2+��ˮ������2���ٹ�����Ҫ�ò������������������Դ�����δʹ�ò�������������ȷ�������Ѿ�ϴ�Ӹɾ��ķ����ǣ�ȡ����ϴ��Һ�������еμ������ữ���Ȼ�����Һ����������ɫ����������ϴ�Ӹɾ�����3���¶�̫�ͷ�Ӧ���������¶ȸ߹��������ֽ⣬����ά���¶���40����������4����������FeC2O4��2H2O��H2O2��H2C2O4��K2C2O4�������������(��)��أ���Ӧ����ʽ��2FeC2O4��2H2O+H2O2+H2C2O4+3C2O42-=2[Fe(C2O4)3]3-+6H2O����5�����������(��)��ؾ�������¼��ɷֽ�����CO2������������ԭ��Ӧ���ɣ����ɵIJ�������K2C2O4��FeC2O4���÷ֽⷴӦ�Ļ�ѧ����ʽ��2K3[Fe(C2O4)3]��3H2O![]() 3K2C2O4+2FeC2O4+2CO2��+6H2O��
3K2C2O4+2FeC2O4+2CO2��+6H2O��


 �żӾ���ϵ�д�
�żӾ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸx��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯����ͼ��ʾ�������жϳ���Ԫ�ػش�������

��1��y��Ԫ�����ڱ���λ����_____��
��2���Ƚ�g��h����̬�⻯��Ļ�ԭ��ǿ���ǣ�_____��_____��
��3����ѡ����Ԫ�����һ����ԭ�ӹ��ۻ����д�������ʽ_____��
��4������Ԫ�ؿ������R��zx4f(gd4)2,��ʢ��10mL1molL�\1R��Һ���ձ��еμ�1molL�\1NaOH��Һ���������ʵ�����NaOH��Һ����仯ʾ��ͼ���£�

��д��m�㷴Ӧ�����ӷ���ʽ_____��
����R��Һ�ļ�20mL1.2 molL�\1Ba(OH)2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǽ�������A��������ͼ��ʾ�Ĺ���ת��Ϊ������D����֪DΪ����ǿ��
![]()
��ش��������⣺
��1����A�ڳ�����Ϊ���壬B����ʹƷ����Һ��ɫ���д̼�����ζ����ɫ����
��D�Ļ�ѧʽ��
���ڹ�ҵ������B����Ĵ����ŷű���ˮ���պ��γ��� ����Ⱦ�˻���
��2����A�ڳ�����Ϊ���壬C�Ǻ���ɫ���塣��A��C�Ļ�ѧʽ�ֱ��ǣ�A ��C
��D��Ũ��Һ�ڳ����¿���ͭ��Ӧ������C���壬��д���÷�Ӧ�Ļ�ѧ����ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϸ���и��ֻ�����ռϸ�����صĺ��������Ӷൽ�ٵ�˳�����У���ȷ����( )
A��ˮ�������ʡ����ࡢ֬�� B�������ʡ����ࡢ֬�ʡ�ˮ
C�������ʡ�ˮ��֬�ʡ����� D��ˮ�������ʡ�֬�ʡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ��ԭ��أ�����˵������ȷ����

A. ��װ���ܽ���ѧ��ת��Ϊ����
B. ZnΪ����������������Ӧ
C. �����ķ�ӦΪ 2H+ + 2e- =H2��
D. ������ͭƬͨ����������пƬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ����������ϢϢ��أ���ش���������
��1��ij�¶��£�Kw=1��10��12�� molL��1��2 �� �������¶Ȳ��䣬��ˮ�е���ϡ����ǡ��ʹ��Һ��c��H+��/c��OH����=1��1010 �� ���ʱˮ�������c��H+��=molL��1 ��
��2������������Һ��pH=3��HA��ҺV1 mL��pH=11��NaOH��ҺV2 mL��϶��ã�������˵����ȷ���� ��
A.����Ϻ���Һ�����ԣ���c��H+��+c��OH����=2��10��7mol/L
B.��V1=V2 �� ��Ϻ���Һ��pHһ������7
C.����Ϻ���Һ�����ԣ���V1һ������V2
D.����Ϻ���Һ�ʼ��ԣ���V1һ��С��V2
��3�����������У������������ᣨ�ף�Ka=1.8��10��5 mol/L����һ�����ᣨ�ң�Ka=1.4��10��3 mol/L����ˮ�еĵ������Ũ�ȹ�ϵ���� �� 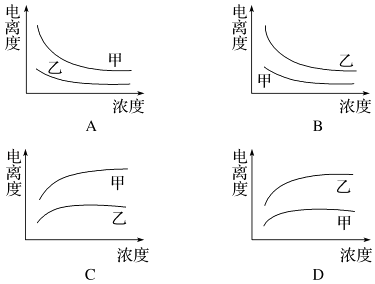
��4��������ʵ���У���֤���������Ա��������������� ��
A.���������pH=4������ʹ���ϡ�ͳ�pH=5����Һ�������������ˮ���Ķ���
B.����������pH������ʹ����зֱ����ͬ������Ӧ���ι��壬����Һ��pH���ޱ仯
C.����������Ũ�ȵ�����ʹ���ֱ��������п�ۣ������������������
D.�õ��������Ũ�ȵ�����ʹ�����������ʵ�飬���ݵ��ݵ������̶ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��M Ϊԭ��������������Ķ���������Ԫ�ء���֪����Ԫ�ض�Ӧ��ԭ�Ӱ뾶��СΪ��X<Z<Y<M<W���� Y ������л���ı�ҪԪ�� �� Z �� X ���γ����ֳ����Ĺ��ۻ������ W ���γ����ֳ��������ӻ�̨��� M �ĵ��Ӳ�����������������ȡ�����˵������ȷ����
A. W��M ��ԭ�Ӱ뾶Ϊ M<W
B. YZ2Ϊֱ���εĹ��ۻ����W2Z2�Ⱥ������Ӽ��ֺ��й��ۼ�
C. Z �� X �γɵĻ�������۷е�ƫ������������ڴ������
D. Z �� M �γɵĻ��������Ϊ���²���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л����˵������ȷ���ǣ�������
A.2013��11��ɽ���֡�������ݡ�������ѧƷй©��1��7�ж����û�ѧƷΪ���������������һ����ɫ��Һ�壬������ˮ���������Ҵ������ѣ����������࣬Ҳ����±����
B.��ϵͳ�������� ![]() ������Ϊ2��7��7��������3���һ�����
������Ϊ2��7��7��������3���һ�����
C.�������黷��һ�ȴ����ͬ���칹�干��3��
D.ij�ִ����ʵ������������������ᷢ��������Ӧ�����ɵ�������Է�������a��ԭ��������Է�����b�Ĺ�ϵ��a=b+84����ô������о����������ǻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����·�Ӧ�ɻ��������Դ������(CH3OCH3)������˵������ȷ����
��C(s)+H2O(g)==CO(g)+H2(g) ��H1=akJ/mol
��CO(g)+H2O(g)==CO2(g)+H2(g) ��H2=bkJ/mol
��CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ��H3=ckJ/mol
��2CH3OH(g)==CH3OCH3(g)+H2O(g) ��H4=dkJ/mol
A. ��Ӧ������Ϊ��Ӧ���ṩԭ��������a>0
B. ��Ӧ��Ҳ��CO2��Դ�����õķ���֮һ
C. ��ӦCH3OH(g)==1/2CH3OCH3(g)+1/2H2O(g)����H=d/2kJ/mol
D. ��Ӧ2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g)����H=-(2b+2c+d)kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com