
| A、Fe3+ NH4+ SCN- Cl- |
| B、Ba2+ H+ NO3- SO42- |
| C、Fe3+ Fe2+ Na+ NO3- |
| D、Fe2+ NH4+ Cl- OH- |
科目:高中化学 来源: 题型:
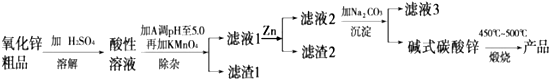
查看答案和解析>>
科目:高中化学 来源: 题型:
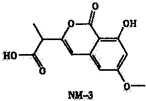 M-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )
M-3是种正处于临床试验阶段的小分子抗癌药物,其结构如图所示(未表示出其空间构型).下列关于NM-3的性质描述正确的是( )| A、不含有手性碳原子 |
| B、能使溴的四氯化碳溶液褪色 |
| C、能与FeC13溶液发生显色反应 |
| D、1mo1该物质最多可与2mo1NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Na+、SO42-、Cl- |
| B、K+、Na+、HCO3-、NO3- |
| C、OH-、HCO3-、Ca2+、Na+ |
| D、Ba2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| M | |||||||
| X | Y | Z | |||||
| W |
| A、Y、M形成的气态化合物在标准状况下的密度为0.76 g.L-1 |
| B、原子半径:W>Z>Y>X>M |
| C、由X元素形成的单质一定是原子晶体 |
| D、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、221 kJ |
| B、557 kJ |
| C、242 kJ |
| D、188 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
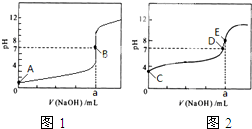 食醋分为酿造醋和配制醋两种.国家标准规定酿造食醋总酸含量不得低于3.5g/100mL.
食醋分为酿造醋和配制醋两种.国家标准规定酿造食醋总酸含量不得低于3.5g/100mL.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com