
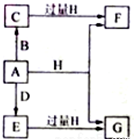
 A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性.它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题.
A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性.它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题.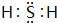 .
.分析 A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,则A为S;B、D是气体,均与硫单质反应,而D与硫反应生成的E有漂白性,则D为O2,E为SO2.F、G、H的焰色反应均为黄色,均含有Na元素,水溶液均显碱性,结合转化关系可知,H为NaOH、G为Na2SO3,F为Na2S,B为H2,C为H2S,据此解答.
解答 解:A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,则A为S;B、D是气体,均与硫单质反应,而D与硫反应生成的E有漂白性,则D为O2,E为SO2.F、G、H的焰色反应均为黄色,均含有Na元素,水溶液均显碱性,结合转化关系可知,H为NaOH、G为Na2SO3,F为Na2S,B为H2,C为H2S.
(1)A为硫,硫元素处于第三周期第ⅥA族,C为H2S,电子式为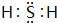 ,
,
故答案为:第三周期第ⅥA族;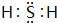 ;
;
(2)硫与NaOH溶液在加热条件下反应的化学方程式为:3S+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2Na2S+Na2SO3+3H2O,
故答案为:3S+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2Na2S+Na2SO3+3H2O.
点评 本题考查无机物推断,涉及S元素单质化合物性质,焰色反应及特殊反应为推断突破口,需要学生熟练掌握元素化合物的性质.


科目:高中化学 来源: 题型:选择题
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表是元素周期律的具体表现形式 | |
| B. | 元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化 | |
| C. | 同周期第IA族与第VA族原子序数之差可能是4、14、28 | |
| D. | 同主族原子序数之差不可能是:10、16、18、26、34、36、50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
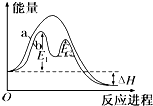
| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为吸热反应,热效应等于△H | |
| C. | 反应过程a有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
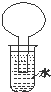 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )| A. | 只能生成CH3Cl一种有机物 | B. | 烧瓶内液面不可能上升 | ||
| C. | 大试管内的液体可能会分层 | D. | 向水中加入石蕊试液后无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
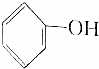 >HCO3-,下列化学方程式不正确的是( )
>HCO3-,下列化学方程式不正确的是( )| A. | 2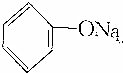 +H2O+CO2→2 +H2O+CO2→2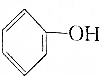 +Na2CO3 +Na2CO3 | B. | 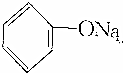 +H2O+CO2→ +H2O+CO2→ +NaHCO3 +NaHCO3 | ||
| C. |  +Na2CO3→ +Na2CO3→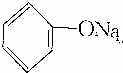 +NaHCO3 +NaHCO3 | D. | 2 +2Na→2 +2Na→2 +H2↑ +H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
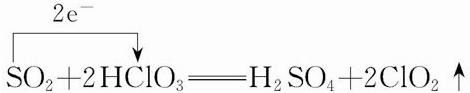 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com