
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. H2O2中加入MnO2, 产生O2的速度加快
C. 3H2 (g)+N2 (g) ![]() 2NH3 (g),ΔH< 0反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
2NH3 (g),ΔH< 0反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
D. 氨水应密闭保存、放置于低温处
【答案】B
【解析】A. 在光照下,新制氯水中的次氯酸会见光分解,次氯酸浓度减小,使得Cl2 +H2O ![]() HCl + HClO的化学平衡向右移动,氯气的浓度减小,溶液颜色变浅,所以可用勒夏特列原理解释,故A错误;
HCl + HClO的化学平衡向右移动,氯气的浓度减小,溶液颜色变浅,所以可用勒夏特列原理解释,故A错误;
B. H2O2中加入MnO2,MnO2作为催化剂,只能改变反应速率,不能使化学平衡移动,故不能用勒夏特列原理解释,故B错误;
C.合成氨的正反应是放热反应,降低温度平衡向右移动,使生成的氨气增多,所以为提高氨气的产率,理论上应采取相对较低温度的措施,故可用勒夏特列原理解释,所以C错误;
D.氨水中存在溶解平衡:NH3+H2O ![]() NH3·H2O,在密闭容器中,总体积一定,一旦氨气逸出,瓶内压强增大,会使平衡向右移动,从而减少氨水的挥发,而氨水受热会分解产生氨气,即正反应是放热反应,在低温处可使平衡向右移动,也减少了氨水的挥发,故氨水应密闭保存、放置于低温处可用勒夏特列原理解释,故D错误;
NH3·H2O,在密闭容器中,总体积一定,一旦氨气逸出,瓶内压强增大,会使平衡向右移动,从而减少氨水的挥发,而氨水受热会分解产生氨气,即正反应是放热反应,在低温处可使平衡向右移动,也减少了氨水的挥发,故氨水应密闭保存、放置于低温处可用勒夏特列原理解释,故D错误;
所以答案选B。


科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、A13+、Ba2+、NH4+、CO32-、NO3ˉ、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。
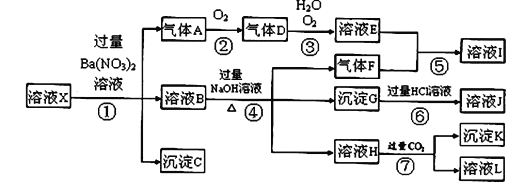
根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有____________________。
(2)溶液X中关于硝酸根离子的判断,正确的是_______;(填编号,下同)
a. 一定含有 b. 一定不含有 c.可能含有
(3)气体F的电子式为__________,化合物I中含有的化学键类型有________;
(4)转化⑦的离子方程式为_________________________________________;
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是_________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于吸热反应的是( )
A. 锌粒投入稀硫酸中产生氢气 B. 生石灰溶于水
C. 酸碱中和 D. Ba(OH)2·8H2O与NH4Cl晶体混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A (g) + B (g) ![]() 3C (g)的下列叙述中,不能说明反应已达到平衡的是( )
3C (g)的下列叙述中,不能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗a mol A,同时生成3a mol C
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以丙烯为原料合成抗炎药物D和机体免疫增强制剂Ⅰ的合成路线如下(部分反应条件和产物己经略去):
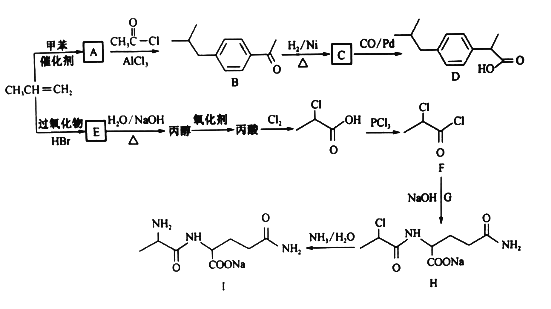
已知: +HCl
+HCl
回答下列问题:
(1)A的结构简式________,由H生成I的反应类型为______________。
(2)E的名称为_____________。
(3)化合物G的化学式为C5H10O3N2,则其结构简式为___________________。
(4)由E生成丙烯的化学方程式为 __________________________________。
(5)分子式为C9H10O2的有机物J和D是同系物,J的结构共有________种。
(6)结合上述流程中的信息,设计由制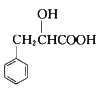 制备
制备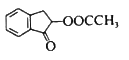 的合成路线:_________________。(其他试剂自选)
的合成路线:_________________。(其他试剂自选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA (g) + bB (s) ![]() cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
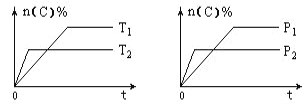
A. 温度降低,化学平衡向逆反应方向移动
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a <c+d
D. 无法根据图像确定改变温度后化学平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 室温下,分别在2 mL ,0.1 mol/L HCl与0.1 mol/L CH3COOH溶液中投入足量镁条。
(1)反应前两溶液的pH:pH(盐酸) _______ pH(醋酸)(选填“>”、“<”或“=”,以下2空相同)。
(2)开始时与镁条反应的速率:v(盐酸) ________v(醋酸)。
(3)最终生成氢气的物质的量:盐酸________醋酸。
(4)反应前盐酸中c(OH-)=_________mol/L。
II. 分别在2 mL 氢离子浓度均为0.1 mol/L的盐酸与醋酸溶液中投入足量的镁条。
(5)开始时与镁条反应的速率:v(盐酸)_____v(醋酸)(选填““>”、“<”或“=”,以下2空相同)。
(6)两种酸起始的物质的量浓度:c(盐酸) ______c(醋酸)。
(7)最终生成氢气的的物质的量:盐酸______醋酸。
III. 已知次磷酸H3PO2是一元弱酸,20℃ 时的电离常数K ≈ 0.1。
(8)写出它的电离方程式______________________________。
(9)写出K的表达式:K=________, 0℃ 时,0.2 mol/L H3PO2溶液的pH =_____(平衡时c(H3PO2)不做近似处理)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X,Y,Z,W(含同一元素)有如转化关系,若X是一种单质,W为一种含氧酸,则X不可能是( )
X ![]() Y
Y ![]() Z
Z ![]() W.
W.
A.N2
B.C
C.S
D.Si
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com