
【题目】下列物质中属于碱性氧化物,既能与水反应生成碱,又能与酸反应生成盐和水的是( )
A.Na2OB.CO2C.NaOHD.CuO
科目:高中化学 来源: 题型:
【题目】按要求填空.
(1)下列两幅谱图是结构简式为CH3CH2CH2OH和CH3CH(OH)CH3的两种有机化合物的1H核磁共振谱图.请判断哪一幅是CH3CH(OH)CH3的1H﹣NMR谱图。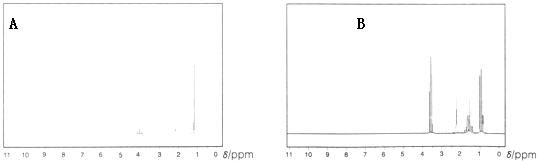
答:
(2)写出下列有机物的结构简式
异戊烷 氯乙烷
丙烯 乙酸乙酯
(3)下图是维生素A的分子结构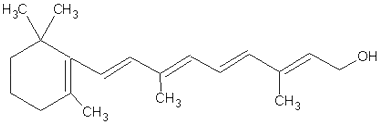
维生素A中的含氧官能团是(写名称),维生素A的分子式是
(4)写出C3H5Cl的链状的所有同分异构体 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则某气体的相对分子质量为( )
A. 32 B. 60 C. 28 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P可用作光电材料,其合成路线如下:

已知:
i: ![]() (R,R’表示氢或烃基)
(R,R’表示氢或烃基)
ii. 
iii. 
(1)烃A的相对分子质量是26,其结构简式是_________。
(2)反应①的反应类型是__________。
(3)C中含有的官能团名称是___________。
(4)D为苯的同系物,反应③的化学方程式是_________。
(5)G的结构简式是__________。
(6)反应⑨的化学方程式是__________。
(7)反应⑤和⑦的目的是___________。
(8)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分. 
(1)其中代表金刚石的是(填编号字母,下同) , 金刚石中每个碳原子与个碳原子最接近且距离相等.金刚石属于晶体;
(2)其中代表石墨是 , 其中每个正六边形占有的碳原子数平均为个;
(3)代表干冰的是 , 它属于晶体,每个CO2分子与个CO2分子紧邻;
(4)上述三种物质熔点由高到低的排列顺序为 .
(5)含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大,即(HO)mROn中,n值越大,酸性越 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中能证明碳的非金属性比硅强的是( )
①往Na2SiO3溶液中通入CO2产生白色沉淀
②石墨是导体,晶体硅是半导体
③制玻璃过程中发生反应Na2CO3+SiO2 ![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
④CH4比SiH4稳定.
A.①④
B.②③
C.③④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
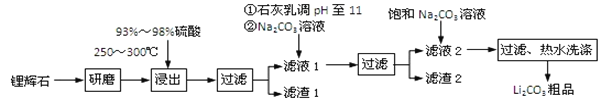
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
回答下列问题:
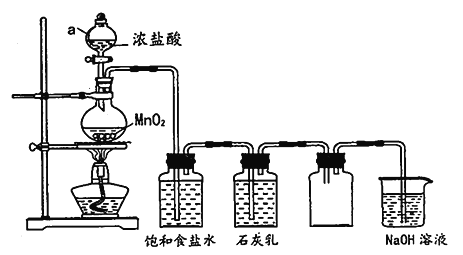
(1)甲装置中仪器a的名称是_____________________。
(2)装置乙中饱和食盐水的作用是_____________________。
(3)①制取漂白粉的化学方程式是______________________________。
②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],则产物中还混杂有物质的化学式是______。
③为提高Ca(ClO)2的含量,,可采取的措施是__________________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________(用化学方程式表示)。
(5)家庭中常用84 消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)清洁卫生。两者同时混合使用会产生有毒的氯气,写出该反应的离子方程式________________________________。
(6)实验室用MnO2跟浓盐酸反应时,当盐酸浓度低于8mol/L时就不能生成氯气。某兴趣小组在圆底烧瓶中实际加入了MnO28.7g,20mL36.5%的浓盐酸(密度1.18g/mL),充分反应后最多能够收集到_______L标准状况下的氯气(保留3位有效数字,不考虑反应过程中溶液体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com