
����Ŀ��I��д�����з�Ӧ�����ӷ���ʽ��
��1����ȡ����������������ӷ���ʽ��________________��
��2����ǿ����Һ�д���������Fe(OH)3��Ӧ����Na2FeO4�����ӷ���ʽ��___________��
II��ij��ɫ��Һ�����п��ܴ���Na+��Ba2+��AlO2����S2����SO32����SO42����ȡ����Һ�����й�ʵ�飬ʵ������ͼ��ʾ����ش�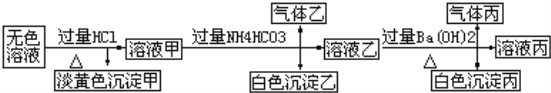
��1�����ɳ��������ӷ���ʽΪ____________________________________________________��
��2������Һ�����ɳ����ҵ����ӷ���ʽΪ______________________________________________��
��3���������ijɷ�Ϊ_______��
��4���ۺ�������Ϣ������Һ�п϶����ڵ����У�___________________________________________��
���𰸡� Fe3++3H2O![]() Fe(OH)3(����) + 3H+ 3ClO-+2Fe(OH)3+4OH-=2FeO42-+ 3Cl-+ 5H2O 2S2-+SO32- =3S�� +3H2O Al3++3HCO3���TAl��OH��3��+3CO2�� һ������BaCO3�����ܺ���BaSO4 Na+��AlO2����S2����SO32��
Fe(OH)3(����) + 3H+ 3ClO-+2Fe(OH)3+4OH-=2FeO42-+ 3Cl-+ 5H2O 2S2-+SO32- =3S�� +3H2O Al3++3HCO3���TAl��OH��3��+3CO2�� һ������BaCO3�����ܺ���BaSO4 Na+��AlO2����S2����SO32��
��������I��(1)��ȡ����������������ӷ���ʽΪFe3+ +3H2O ![]() Fe(OH)3(����) + 3H+���ʴ�Ϊ��Fe3+ +3H2O
Fe(OH)3(����) + 3H+���ʴ�Ϊ��Fe3+ +3H2O ![]() Fe(OH)3(����) + 3H+��
Fe(OH)3(����) + 3H+��
(2)��ǿ����Һ�д���������Fe(OH)3��Ӧ����Na2FeO4�����ӷ���ʽΪ3ClO- +2Fe(OH)3 +4OH-=2FeO42- + 3Cl- + 5H2O���ʴ�Ϊ��3ClO- +2Fe(OH)3 +4OH-=2FeO42- + 3Cl- + 5H2O��
II������ɫ��Һ��HBr��������ɫ�������ó���ֻ��ΪS������2S2-+SO32-+6H+=3S��+3H2O��˵��һ������S2-��SO32-���������ӹ����֪һ��������Ba2+��Al3+��CO32-��SO42-���ܴ��ڣ�������ҺҪ�ʵ����ԣ���Na+һ�����ڣ���ɫ������ӦΪԭ��Һ�к��е�AlO2-�����HBr��Ӧ����Al3+��HCO3-����˫ˮ��õ�Al(OH)3��������Ϊ������̼���ټӹ���Ba(OH)2��Ӧ����NH4HCO3��������ɫ������һ����̼�ᱵ����������BaSO4�������Ϊ������
(1)������Ϊ����������S�ķ�Ӧ����Һ��S2-��SO32-�����������·������з�Ӧ�õ����������ɳ��������ӷ���ʽΪ��2S2-+SO32-+6H+=3S��+3H2O���ʴ�Ϊ��2S2-+SO32-+6H+=3S��+3H2O��
(2)��Һ�к�S2-��SO32-����һ������Ba2+��Al3+������Һ�������NH4HCO3��õ���ɫ����һ����Al(OH)3�������ó�����ԭ��һ����ԭ��Һ�к��е�AlO2-�����HBr��Ӧ����Al3+��HCO3-����˫ˮ��õ�Al(OH)3���������ɳ����ҵ����ӷ���ʽΪ��Al3++3HCO3-=Al(OH)3��+3CO2�����ʴ�Ϊ��Al3++3HCO3-=Al(OH)3��+3CO2����
(3)��������������ʣ��NH4HCO3��Ba(OH)2��Ӧ�õ�BaCO3��Ҳ������BaCO3����Һ���ܺ��е�SO42-��Ba(OH)2��Ӧ�õ�BaSO4�Ļ����ʳ����������ǣ�BaCO3��BaCO3��BaSO4�Ļ��� �ʴ�Ϊ��һ������BaCO3�����ܺ���BaSO4��
(4)���ݷ�����֪һ����������Ϊ��S2-��SO32-��AlO2-��Na+��һ������������Ϊ��Ba2+��Al3+����ȷ���Ƿ��е�����Ϊ��CO32-��SO42-���ʴ�Ϊ��Na+��S2-��SO32-��AlO2-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̵ĵ��ʼ��仯�������;�dz��㷺.�ش��������⣺
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ_______����d�����δ�ɶԵ�����Ϊ__________.
��2��MnO���۵㣨1650�棩��MnS���۵㣨1610�����ߣ����Ƕ�����___���塣ǰ���۵�ϸߵ�ԭ����_____________��
��3���̵�һ�������Ļ�ѧʽΪMn(BH4)2(THF)3��THF�Ľṹ��ʽ��ͼ��ʾ��

�� ��Mn2+�γ���λ����ԭ��Ϊ_______����Ԫ�ط��ţ���
�� BH4-�Ŀռ乹��Ϊ_______������Bԭ�ӵ��ӻ��������Ϊ________��
�� д��������BH4-��Ϊ�ȵ�����ķ��ӻ����ӣ�___________��
��4��һ�ִ��Բ��ϵĵ������ṹ��ͼ��ʾ��

�� �þ�����̼ԭ�ӵ�ԭ������Ϊ________��
�� Mn�ھ����еĶѻ���ʽΪ________�����������������������������������������������������ܣ�) �ѻ���
�� ���þ����ı߳�Ϊa pm,NA��ʾ�����ӵ���������ֵ����þ����ܶȵı���ʽΪ��=_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ�У�A��һ�ֳ����ĵ��ʣ�B��C��D��E�Ǻ�AԪ�صij�����������ǵ���ɫ��Ӧ�Ļ�����ʻ�ɫ��

��д���пհ�:
(1)д����ѧʽ:A_____��B_____��D______________��
(2)���Ϸ�Ӧ������������ԭ��Ӧ����_____(�����)��
(3)д����Ӧ�ݵ����ӷ���ʽ:___��д����Ӧ�Ļ�ѧ����ʽ:___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¹���ѧ�ҹ���(F. Haber, 1868-1930)�����ĺϳ�������ʹ�����е�����������������ʵ������ݽߵ�������Դ���Ӷ�ʹũҵ���������������̶ȼ���������˵���������ʳ���㵼�µļ������������⡣�����λ���������ʳΣ���Ļ�ѧ��Ż����1918��ŵ������ѧ��������������ʵ����ģ�ҵ�����Ĺ��̣���̽�����������ƽ���Ӱ����
������������������������ݣ�
��ѧ�� | N��N | H-H | N-H |
����/(kJ/mol) | 946 | 436 | 391 |
(1)���㹤ҵ�ϳ�����Ӧ�ķ�Ӧ�ȣ�N2(g)+3H2(g) ![]() 2NH3(g) ��H=________ kJ/mol
2NH3(g) ��H=________ kJ/mol
(2)һ���¶��£���һ����ѹ�����г���N20.6mol��H2 0 .5mol����һ�������½��з�Ӧ��N2(g)+3H2(g) ![]() 2NH3(g)���ﵽƽ��ʱ��N2��ת����Ϊ1/6����ʱ���������Ϊ1L��
2NH3(g)���ﵽƽ��ʱ��N2��ת����Ϊ1/6����ʱ���������Ϊ1L��
��������ʱ������ƽ����ϵ��ƽ�ⳣ����______________��
��������ƽ��ʱ���¶���ѹǿ���䣬������ƽ����ϵ��ͨ��0.9mol N2����ƽ�⽫_______(������������������������)�ƶ���
(3)������ѹǿ��ȣ��¶ȷֱ�ΪT1��T2�������г�����1 mol N2��3 molH2��ɵĻ�����壬������ӦN2(g)+3H2(g) ![]() 2NH3(g)��ƽ���ı���������������� N2�����������ѹǿ�ı仯��ͼ��ʾ����ͼ�ж�����˵����ȷ����______________
2NH3(g)��ƽ���ı���������������� N2�����������ѹǿ�ı仯��ͼ��ʾ����ͼ�ж�����˵����ȷ����______________

a.A�� B�� C�����ƽ�ⳣ����С��ϵ��KA<KB<KC
b.B���C���H2Ũ�ȴ�С��ϵ��B<C
c.A���B�����������ܶȴ�С��ϵ��A<B
d.A���C����������ƽ���������������С��ϵ��A>C
(4)�ϳɰ���ҵ���������������CO2����ҵ�ϳ��ø�Ũ�ȵ�K2CO3��Һ����CO2��,����ҺX�������õ�ⷨK2CO3��Һ��������װ����ͼ��ʾ��

���������������ķ�Ӧ����____________________��H++ HCO3-=H2O+CO2����
�ڼ���CO32-��������������ԭ��________________��
������װ���в�����CO2��H2��һ�������·�Ӧ���ɼ״�����ҵ�����ø÷�Ӧ�ϳɼ״���
��֪��25 �棬101 KPa�£�
2H2(g)+ O2(g)=2H2O(g) �� H1=-484kJ/mol
2CH3OH(g)+3 O2(g)=2CO2(g)+4H2O(g) �� H2=-1352kJ/mol
д��CO2��H2����1molCH3OH(g)���Ȼ�ѧ����ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijpH=1��ZnCl2��HCl�Ļ����Һ�к���FeCl3���ʣ�ͨ��ˮ���ȥ���ʣ��轫��Һ����pH=4���ڵ�����ҺpHʱ��Ӧѡ�õ��Լ���
A.NaOHB.ZnOC.Na2CO3D.Fe2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ǿ����ȫ������ij�Ϳ�������һ̨���������ͺ����IJ����ǣ��乤��ԭ����ͼ��ʾ����ǿ������Һ���������Һ��������˵���в���ȷ����

A. ʯī�缫��������������ԭ��Ӧ
B. ���缫�ĵ缫��ӦʽΪ��C8H18+16H2O-50e-=8CO2+50H+
C. H+�����ӽ���Ĥ������Ҳ�Ǩ��
D. ÿ���ı�״����5.6 L O2��Һ��ͨ��lmol ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(![]() )��������ȡ���ܼ�����Ϊ��ҵ�ܼ�������˵����ȷ���ǣ� ��
)��������ȡ���ܼ�����Ϊ��ҵ�ܼ�������˵����ȷ���ǣ� ��
A. ��������������12��ԭ�ӹ�ƽ��
B. �뻷������Ϊͬ���칹�壬�Һ���ȩ������CHO���Ľṹ��8�֣���������ṹ��
C. ��״���£�1mol������������Na��Ӧ����22.4LH2
D. ��������һ�ȴ�����3�֣���������ṹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ���ĸ�����������ȷ���ǣ� ��
A�������ӻ������ֻ�������Ӽ� B���Ǽ��Լ�ֻ������˫ԭ�ӵĵ��ʷ�����
C�����ۻ������һ�����������Ӽ� D����ͬԪ����ɵĶ�ԭ�ӷ����ֻ���ڼ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е�Ԫ�أ�����ͬһ���ڵ���
A.Mg��Al��PB.O��Na��SC.N��O��ClD.H��Li��Na
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com