
A、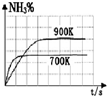 N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol |
B、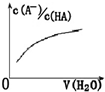 向弱酸HA的稀溶液中加水稀释 |
C、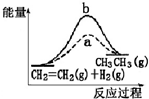 有正催化剂(a)和无催化剂(b)时反应的能量变化 |
D、 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液 |
| c(A-) |
| c(HA) |
| c(A-) |
| c(HA) |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
| A、Mg2+、Ba2+、Cl-、NO3- |
| B、K+、AlO2-、Cl-、SO42- |
| C、Na+、K+、NO3-、HCO3- |
| D、Al3+、Cl-、CO32-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/(min) | n(A)/( mol) | n(B)/( mol) | n(C)/( mol) |
| 0 | 1 | 3 | 0 |
| 第2 min | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
| 第8 min | 0.1 | 2.0 | 1.8 |
| 第9 min | 0.05 | 1.9 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用聚氯乙烯塑料袋包装食品 |
| B、在食用盐中添加适量的碘酸钾 |
| C、在食品加工中科学使用食品添加剂 |
| D、研发高效低毒的农药,降低蔬菜的农药残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ |
| C、②④ | D、①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入乙烷的电极为正极 |
| B、参加反应的乙烷与氧气的物质的量之比为7:2 |
| C、负极反应式为C2H6+6H2O-→2CO32-+18H++14e- |
| D、放电一段时间后,KOH的物质的量浓度减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:

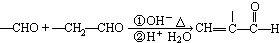

| NaCN |
| H+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B、向AgCl的悬浊液中加入0.1 mol?L-1KI溶液,沉淀可由白色转化为黄色 |
| C、将0.001 mol?L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 |
| D、向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com