
分析 根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式,方程中的热量和化学计量数要对应;氢气的燃烧热是值1mol氢气完全燃烧生成液态水放出的热量,单位是kJ/mol;根据m=nM结合9g水蒸气转化成液态水放热22kJ计算1mol气态水转化成液态水放出的热量,结合氢气与氧气反应生成气态水的反应热计算生成液态水的反应热.
解答 解:氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol;
9g即0.5mol水蒸气转化成液态水放热22kJ,故18g即1mol水蒸气转化成液态水放出热量22kJ×2=44kJ,故反应H2(g)+$\frac{1}{2}$O2(g)═H2O(l)的反应热△H=-(241.8kJ/mol+434kJ/mol)=-285.6kJ/mol,故氢气的燃烧热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l),△H=-285.8kJ/mol;
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol;H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol.
点评 本题考查热化学方程式的书写与反应热的计算、燃烧热等,题目难度不大,注意掌握热化学方程式的书写,燃烧热注意把握可燃物为1mol,生成稳定的氧化物.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液与稀盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| B. | 氧化镁中加稀盐酸:2H++MgO═H2O+Mg2+ | |
| C. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| D. | 氢氧化钡溶液与硫酸溶液混合 Ba2++SO42-═BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
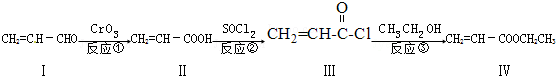
 (注明反应条件).
(注明反应条件).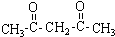 或CH2=CH-O-CH2-O-CH=CH2.
或CH2=CH-O-CH2-O-CH=CH2.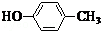 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 适量的HCl气体 | B. | 适量的硫酸氢钠 | C. | 适量的NaOH固体 | D. | 适量的稀HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com