
 下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )
下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )| A. | C2H2 | B. | C2H5OH 蒸汽 | ||
| C. | CH4 | D. | CH4与H2的混合气体 |
分析 A具有干燥剂的作用,可吸收水分.其增加了9g,则为水的质量,则可求氢元素的质量;B可以吸收酸性气体,其增加了11g,则为二氧化碳的质量,则可求碳元素的质量;由碳、氢元素的质量比,根据n=$\frac{m}{M}$计算出C、H的物质的量,再计算出二者物质的量之比,根据计算结构进行判断.
解答 解:设该碳氢化合物的化学式为CxHy,
氢元素的质量为9g×$\frac{2}{18}$×100%=1g,物质的量为:$\frac{1g}{1g/mol}$=1mol,
碳元素的质量为11g×$\frac{12}{44}$×100%=3g,其物质的量为:$\frac{3g}{12g/mol}$=0.25mol,
该有机物分子中含有C、H的物质的量之比为0.25mol:1mol=1:4,
选项中满足条件的只有C,
故选C.
点评 本题考查了有机物分子式的确定,题目难度不大,明确物质的量与摩尔质量的关系为解答关键,注意掌握质量守恒定律在化学计算中的应用方法.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.40mol/L | B. | 0.30mol/L | C. | 0.075mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molH2的质量是1 g | |
| B. | 1 mol HCl的质量是36.5 g•mol-1 | |
| C. | Cl2的摩尔质量等于它的相对分子质量 | |
| D. | SO42-的摩尔质量是96 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应(1)中x=6 | |
| B. | 反应(2)中的氧化产物与氧化剂的物质的量之比为4:5 | |
| C. | 反应(3)中的氧化剂是S,还原剂是KOH | |
| D. | NaClO3、NO、H2O、KOH、K2SO3中均含氧元素,但它们不全为氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 4.0 | 500 | 烧杯、量筒、玻璃棒、药匙、托盘天平、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 失去电子的反应是还原反应 | |
| B. | 在氧化还原反应中不一定所有的元素的化合价都发生变化 | |
| C. | 做氧化剂的物质不能是还原剂 | |
| D. | 发生还原反应的元素对应产物是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
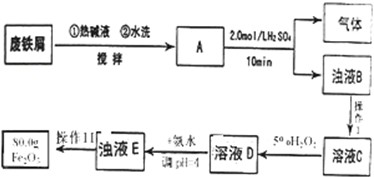
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com