

| 操作步骤 | 实验现象 | 结论 |
| 取少量1中溶液于试管甲中,滴加品红溶液和盐酸. | 品红始终不褪色 | ①无SO2(或HSO3-或SO32-)生成 |
| 另取少量1中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42-生成 |
| ③继续在试管乙中滴加Ba(OH)2 溶液至过量,静置,取上层清液于试管中,加入足量稀硝酸酸化的硝酸银溶液. | 有白色沉淀生成 | 有Cl-生成 |
分析 I.ClO2 的制备:装置A中Cu与浓硫酸发生反应制备二氧化硫气体,在装置B中发生生成二氧化氯的反应,为防止倒吸,A与B之间连接装置E,二氧化氯沸点较低,故在D中冰水浴收集,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,据此分析解答;
II.(5)①品红不褪色,说明无SO2(或HSO3-或SO32-)生成;
②硫酸钡为白色沉淀;
③用硝酸酸化的硝酸银可验证氯离子;
(6)根据实验可知ClO2 与 Na2S 反应有氯离子、硫酸根离子的生成;ClO2除硫效果彻底,氧化产物硫酸根更稳定、ClO2在水中的溶解度大、剩余的ClO2不会产生二次污染、均被还原为氯离子时,ClO2得到的电子数是氯气的2.5倍.
解答 解:I.(1)装置 A 中反应后所得白色固体可能是CuSO4,可结合硫酸铜溶解于水得到蓝色溶液,且浓硫酸稀释时是将浓硫酸沿器壁注入水中,则可将反应后的混合物慢慢倒入盛有少量水的试管里,若固体溶解,溶液变蓝,则白色固体为硫酸铜,故答案为:将反应后的混合物慢慢倒入盛有少量水的试管里,若固体溶解,溶液变蓝,则白色固体为硫酸铜;
(2)装置B中在酸性条件下,SO2通入NaClO3溶液中生成ClO2,发生反应的离子方程式为,故答案为:SO2+2ClO3-=2ClO2+SO42-;
(3)二氧化硫从a进入装置B中反应,为防止倒吸,故应在之前有安全瓶,则a→g→h,为反应充分,故再连接B装置中的b,二氧化氯沸点较低,故在D中冰水浴收集,为充分冷却,便于收集,故连接e,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,连接顺序为:a→g→h→b→c→e→f→d;
故答案为:g→h→b→c→e→f→d;
(4)装置D的作用为冷凝并收集ClO2;
故答案为:冷凝并收集ClO2;
II.(5)将适量的稀释后的 ClO2 通入如图2所示装置中充分反应,得到无色澄清溶液,
①取少量I中溶液于试管甲中,滴加品红溶液和盐酸,品红始终不褪色,说明溶液中无SO2(或HSO3-或SO32-)生成;
故答案为:SO2(或HSO3-或SO32-);
②另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡,有SO42-生成,硫酸根与钡离子反应生成硫酸钡白色沉淀;
故答案为:白色沉淀;
③结论为有Cl-生成,有白色沉淀生成,氯化银为不溶于酸的白色沉淀,检验氯离子,故操作为:继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙内加入足量稀硝酸酸化的硝酸银溶液;
故答案为:加入足量稀硝酸酸化的硝酸银溶液;
(6)由上述分析可知ClO2 与 Na2S 反应有氯离子、硫酸根离子的生成,故发生的离子方程式为:8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+;ClO2除硫效果彻底,氧化产物硫酸根更稳定、ClO2在水中的溶解度大、剩余的ClO2不会产生二次污染、均被还原为氯离子时,ClO2得到的电子数是氯气的2.5倍;
故答案为:8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+;ClO2除硫效果彻底,氧化产物硫酸根更稳定、ClO2在水中的溶解度大、剩余的ClO2不会产生二次污染、均被还原为氯离子时,ClO2得到的电子数是氯气的2.5倍.
点评 本题考查了物质的制备和性质探究,涉及方程式的书写,实验装置的连接等知识点,综合性较强,侧重于对学生将知识运用和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同素异形体:活性炭,C60,石墨,金刚石 | |
| B. | 酸性氧化物:CO2,SO2,SiO2,Mn2O7 | |
| C. | 混合物:铝热剂,纯净矿泉水,液氯,漂白粉 | |
| D. | 非电解质:乙醇,四氯化碳,氨气,葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
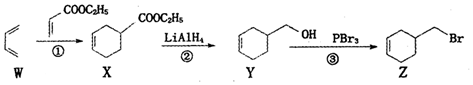
| A. | 烯烃W名称为1,3-丁二烯,所有原子一定在同一平面上 | |
| B. | ①、②、③的反应类型依次为加成反应、还原反应和取代反应 | |
| C. | 由化合物Z-步制备化合物Y的转化条件是:NaOH醇溶液,加热 | |
| D. | 化合物Y先经酸性髙锰酸鉀溶液氧化,再与乙醇在浓硫酸催化下酯化可得化合物X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在pH=10.3时,溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-) | |
| B. | 在pH=8.3时,溶液中:0.1000>c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 在pH=6.3时,溶液中:c(Na+)>c(Cl-)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | V1:V2=1:2时,c(OH-)>c(HCO3-)>c(CO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.3mol | C. | 0.4mol | D. | 0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y<Z | |
| B. | 阴离子的还原性:Y>W | |
| C. | a一定由W、X两种元素组成 | |
| D. | 图中转化过程d物质在作为反应物时均即为氧化剂又是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com