
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_______。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为__________________(不写反应条件),原子利用率是______________。
(3)属于乙醇的同分异构体的是_______(选填编号)。
A.![]() B.
B.![]() C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗_______mol氧气。
② 乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为____________________。
【答案】小CH2=CH2 + H2O![]() CH3CH2OH100%D3 2CH3CH2OH + O2
CH3CH2OH100%D3 2CH3CH2OH + O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
(1)乙醇的密度比水小,故答案为:小;
(2)乙烯中含双键可和水发生加成反应生成乙醇,反应方程式为:CH2═CH2+H2O→CH3CH2OH,从方程式可看出,反应物全部转化为生产物,原子利用率为100%,故答案为:CH2═CH2+H2O→CH3CH2OH;100%;
(3)分子式相同结构不同的有机物互称同分异构体,故乙醇的同分异构体为甲醚,故答案为:D;
(4)①46g乙醇的物质的量为:![]() =1mol,C2H5OH+3O2
=1mol,C2H5OH+3O2![]() 2CO2+3H2O,所用1mol乙醇燃烧消耗3mol氧气,故答案为:3;
2CO2+3H2O,所用1mol乙醇燃烧消耗3mol氧气,故答案为:3;
②乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为2C2H5OH+O2![]() 2CH3CHO+2H2O,故答案为:2C2H5OH+O2
2CH3CHO+2H2O,故答案为:2C2H5OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质CaCl2、MgCl2和Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去Mg2+的主要反应:MgCl2+2NaOH-=Mg(OH)2↓+2NaCl
B. 试剂①一定不是Na2CO3溶液
C. 检验SO42-是否除净:取少量滤液,加稀盐酸酸化,再加BaCl2溶液
D. 滤液加稀盐酸时只发生反应:HCl+NaOH=H2O+NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。

可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
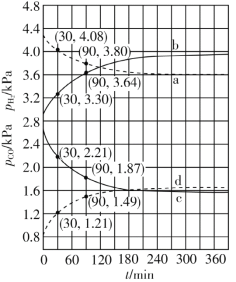
计算曲线a的反应在30~90 min内的平均速率![]() (a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
(a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:

(1) ClO2中所有原子_____________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用_________
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2) 稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是_________
A.二氧化氯可广泛用于工业和饮用水处理
B.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
C.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3) 欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为______________________。
(4) 我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 __________________,此法相比欧洲方法的优点是______________________。
(5) 科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为_____________________________。此法提高了生产及储存、运输的安全性,原因是 _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的HCO3-、CO32-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
B.V1∶V2=1∶5
C.M点时生成的CO2为0.05 mol
D.e曲线表示的离子方程式为Al(OH)3+3H+===Al3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果把![]() 的相对原子质量定义为24,以
的相对原子质量定义为24,以![]() 所含的C原子数为阿伏加德罗常数,则在标准状况时下列数值肯定不变的是( )
所含的C原子数为阿伏加德罗常数,则在标准状况时下列数值肯定不变的是( )
A.浓硫酸(![]() )的物质的量浓度
)的物质的量浓度
B.常温下氯化钠的溶解度
C.标准状况下气体摩尔体积.
D.1克拉钻石所含的C原子的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂粉精是常用的消毒剂。
(1)工业上制取漂粉精的化学方程式为______________________,在使用漂粉精时,为了加速漂白作用,可以在漂粉精中加入少量________________.
(2)漂粉精暴露在空气中易失效的主要原因是___________、_______________(用化学方程式表示)
(3)浓盐酸和次氯酸钙能发生如下反应Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂粉精和浓盐酸反应制得的氯气中,可能含有的杂质气体是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
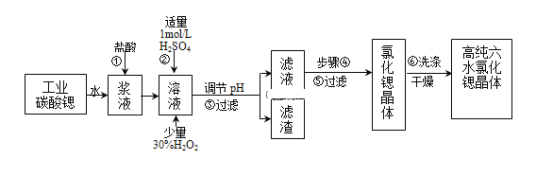
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl26H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①需要加快反应速率,措施有充分搅拌和______(写一种).碳酸锶与盐酸反应的离子方程式______.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至______;宜用的试剂为______.
A.1.5B.3.7C.9.7D.氨水E.氢氧化锶粉末F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是______(填化学式).
(4)工业上用热风吹干六水氯化锶,适宜的温度是______
A.50~60℃B.80~100℃C.100℃以上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 加压,平衡右移,化学平衡常数增大
B. 此时,B的平衡转化率是40%
C. 该反应的化学平衡常数表达式是K=![]()
D. 增加C,B的平衡转化率变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com