
【题目】如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题: 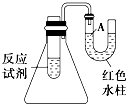
(1)将铝片加入小试管内,然后注入足量稀盐酸,有关反应的离子方程式是 , 试管中观察到的现象是 .
(2)U形导管中液面A(填“上升”或“下降”),原因是 , 说明此反应是(填“吸热”或“放热”)反应.
【答案】
(1)2Al+6H+═2Al3++3H2↑;铝片上有大量气泡生成,铝片逐渐溶解
(2)下降;铝片与稀盐酸反应时放出热量,使锥形瓶内温度升高,气体压强增大;放热
【解析】解:(1)铝片与盐酸反应的离子方程式为2Al+6H+═2Al3++3H2↑,反应现象为铝片上有大量气泡生成,铝片不断溶解,所以答案是:2Al+6H+═2Al3++3H2↑;铝片上有大量气泡生成,铝片逐渐溶解;(2)铝片与盐酸的反应为放热反应,反应放出的热量使气体膨胀,使U形管液面A下降,
所以答案是:下降;铝片与稀盐酸反应时放出热量,使锥形瓶内温度升高,气体压强增大;放热.
【考点精析】解答此题的关键在于理解吸热反应和放热反应的相关知识,掌握化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y所形成的一种单质有毒且易自燃.下列判断不正确的是( ) ![]()
A.最高正化合价:X<Y<Z<W
B.原子半径:W<Z<Y
C.气态氢化物的热稳定性:Y<Z<W
D.最高价氧化物对应水化物的酸性:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去).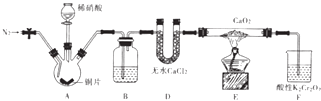
已知:2NO+CaO2═Ca(NO2)2;2NO2+CaO2═Ca(NO3)2
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2 , 原因是 .
(2)仪器D的名称是;B中盛放的试剂是 .
(3)装置F中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3﹣ , 溶液由橙色变为绿色(Cr3+),发生反应的离子方程式是 .
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体.设计实验证明E中有亚硝酸钙生成 .
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2 , 反应原理为Ca(OH)2+NO+NO2=Ca(NO2)2+H2O.
①若n( NO):n(NO2)>1:1,则会导致:
②若n( NO):n( NO2)<1:1,则会导致 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在玻璃中加入溴化银(AgBr)和氧化铜可制得变色镜片,其中所含物质及变色原理如图所示,下列说法不正确的是( )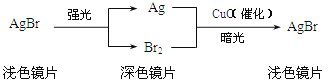
A.溴化银应避光保存
B.变色镜片可反复变色
C.变色镜片颜色变深的过程发生了化合反应
D.变色镜片中的氧化铜在变色过程中质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验操作的说法正确的是
A.稀释浓硫酸时,将蒸馏水沿器壁缓慢注入浓硫酸中
B.过滤时,漏斗里液体的液面要高于滤纸边缘
C.蒸发过程中,蒸发皿中没有水时才能停止加热
D.点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,体积相同、pH均为3的醋酸和硫酸的说法正确的是( )
A.分别加入足量锌片,两种溶液生成H2的体积相同
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO﹣)和硫酸中的c(SO ![]() )相等
)相等
D.两种溶液中,由水电离出的氢离子浓度均为1×10﹣11 mol?L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氯气的性质,某小组用如图所示的微型实验装置进行试验,a、b、c、d、e、是浸有相关溶液的滤纸.小组同学用KMnO4晶体与浓盐酸反应来制取少量的氯气,向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.其化学方程式为:KMnO4+HCl(浓)→KCl+Cl2↑+MnCl2+H2O (未配平),请回答下列问题: 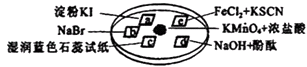
(1)上述反应中,元素的化合价升高;而元素被还原.
(2)配平上述反应: KMnO4+HCl(浓)═KCl+Cl2↑+MnCl2+H2O
(3)c处湿润蓝色石蕊试纸会先后 , 产生此现象的原因是: .
(4)e处滤纸的实验现象是: , 写出氯气与Fe2+反应的离子方程式是: .
(5)上述反应若在标准状况下产生56L的氯气,则转移电子为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝的混合物共0.2mol,溶于200mL4mol·L-1的盐酸溶液中,然后再滴加2 mol·L-1的NaOH 溶液。若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示。请回答下列问题:
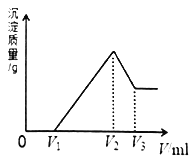
(1)当V1=160mL时,则金属粉末中m(Al)=_____________mol。
(2)V2~V3段发生反应的离子方程式为____________________________。
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则加入NaOH 溶液的体积V(NaOH)=____________mL。
(4)若镁、铝的混合物仍为0.2mol,其中镁粉的物质的量分数为a,改用200mL4 mol·L-1的硫酸溶解此混合物后,再加入840mL 2 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂
(1)5MnSO4 + 2NaClO3 + 4H2O ![]() 5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4 ___________,氧化剂是______
5MnO2 + Na2SO4 + Cl2 ↑+ 4H2SO4 ___________,氧化剂是______
(2)2FeCl3 + 10NaOH + 3NaClO ![]() 2Na2FeO4 + 9NaCl + 5H2O_____________,氧化剂是_____
2Na2FeO4 + 9NaCl + 5H2O_____________,氧化剂是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com