
| A. | 任何条件下,等物质的量O2的和CO所含的分子数必相等 | |
| B. | 0.012 kg 12C 含有约6.02×1023个碳原子 | |
| C. | 在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 | |
| D. | CH4的摩尔质量为16g |
分析 A.分子数与温度和压强无关,分子数=nNA;
B.将12g12C中含有的碳原子个数称为阿伏伽德罗常数;
C.物质的量是表示微观粒子的物理量,需要表明微粒种类;
D.摩尔质量单位是g/mol.
解答 解:A.分子数与温度和压强无关,根据N=nNA知,分子数与物质的量成正比,所以任何条件下,等物质的量O2的和CO所含的分子数必相等,故A正确;
B.将12g12C中含有的碳原子个数称为阿伏伽德罗常数,即0.012kg碳-12含有约6.02×1023个碳原子,故B正确;
C.物质的量是表示微观粒子的物理量,需要表明微粒种类,所以在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类,故C正确;
D.摩尔质量的单位是g/mol,甲烷的摩尔质量是16g/mol,故D错误;
故选D.
点评 本题考查物质的量的有关知识,明确阿伏伽德罗常数含义、摩尔质量单位等知识点是解本题关键,熟练掌握物质的量有关公式,注意:只有计算气体体积时才与温度压强有关,计算分子数、质量、物质的量浓度等时与温度压强无关.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤④② | C. | ①⑤④③② | D. | ①②⑤③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,反应达到平衡时所用的时间越短 | |
| B. | K越小,达到平衡时,反应物的 转化率越大 | |
| C. | K随反应物浓度改变而改变 | |
| D. | K越大,达到平衡时,反应进行的程度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| B. | 用焰色反应鉴别NaCl和KCl | |
| C. | 用丁达尔效应鉴别硫酸钠溶液和硅酸胶体 | |
| D. | 用排水集气法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 92.3% | B. | 75% | C. | 66.75% | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
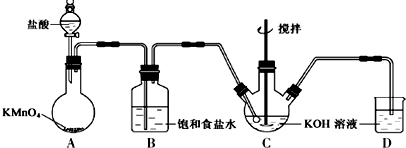
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com