
| 1 |
| 2 |
| A��-417.91kJ?mol -1 |
| B��-319.68kJ?mol -1 |
| C��+546.69kJ?mol -1 |
| D��-448.46kJ?mol -1 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������̼��ʯ��ˮ |
| B��������ƫ��������Һ |
| C�������ʺ�����������Һ |
| D��������������������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����1��ȫ���Ǽ����Ԫ�� |
| B����11��ȫ���ɳ�����Ԫ����� |
| C����3�е�Ԫ��������� |
| D����9��Ԫ�ض��ǽ���Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
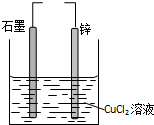
| A�������缫ֱ�����ӣ�e-�����·����п�� |
| B����п�ӵ�Դ������ʯī�ӵ�Դ������п�������� |
| C�������缫ֱ�����ӣ�����Ӧ��Zn-2e-=Zn2+ |
| D����п�ӵ�Դ������ʯī�ӵ�Դ��������Cu2+��ʯī���ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ʵ������������������ֱ���ȫȼ�գ����߷ų������� |
| B����ϡ��Һ�У�H+��aq��+OH-��aq��=H2O��l������H=-57.3 kJ?mol-1��������0.5 mol H2SO4��Ũ�����뺬1 mol NaOH����Һ��ϣ��ų����ȴ���57.3 kJ |
| C����C��ʯī��=C�����ʯ����H=+1.90 kJ?mol-1��֪�����ʯ��ʯī�ȶ� |
| D����101 kPaʱ��2 g H2 ��ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g��=2H2O��g����H=-571.6kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���þ�����ÿ����ԭ��������3����ԭ������ |
| B���þ�������ԭ�Ӿ��壬����N2����ͬ�������� |
| C���߾۵���ը�����ɵ����ų��������ȣ����������ϸø߾۵�����Ϊ����ըҩ |
| D���߾۵�ת��Ϊ������������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A���Ҵ��ڷ�Ӧ�з�����������Ӧ |
| B��Ϊ��ǿ���Ч�������������ữ�ظ������Һ |
| C��ÿ1 mol�Ҵ����뷴Ӧת�Ƶ������ʵ���Ϊ4mol |
| D���Ҵ�������һ�ֽ������Դ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��3.36L |
| B��6.72 L |
| C��8.96 L |
| D��4.48 L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com